Hviid et al. 2019 Impfstoff-Autismus-Studie:
Viel Lärm um nichts?
Jeremy R. Hammond 1, *, Jeet Varia 2 und Brian Hooker 2, *
1 Unabhängiger Forscher
2 Children Health Defense, Franklin Lakes, NJ 0741, USA
* Korrespondenz: jeremy@jeremyrhammond.com (J.R.H.); brian.hooker@childrenshealthdefense.org (B.H.)
Diese Version ist nicht peer-reviewed.
Zusammenfassung: Die Kontroverse um die Impfung gegen Masern, Mumps und Röteln (MMR) und Autismus dauert schon seit über 30 Jahren an. Sie hat ihre Wurzeln in den von Eltern angeführten Grassroots-Bewegungen der 1990er Jahre und wurde 1998 durch eine klinische Fallstudienstudie von Wakefield et al. weiter angeheizt, die einen kausalen Zusammenhang zwischen der MMR-Impfung, Darmentzündungen und Autismus vermutete. Diese Kontroverse zog sich durch zahlreiche Beobachtungsstudien und Berichte des US-amerikanischen Institute of Medicine (IoM) und gipfelte 2019 in einer bevölkerungsbasierten Beobachtungsstudie von Hviid et al. Diese Studie wurde damals von den US-amerikanischen Medien und der medizinischen Fachwelt als schlüssiger Beweis dafür gefeiert, dass die MMR-Impfung das Autismusrisiko nicht erhöht, nicht einmal bei „genetisch anfälligen Kindern“. Wie in dieser kritischen Rezension ausführlich dargelegt, haben Hviid et al. jedoch hat die Daten nicht getreulich zur Prüfung dieser Hypothese beabsichtigt oder interpretiert und kann sie daher unmöglich widerlegt haben. Wir erläutern methodische Mängel, Diskrepanzen, Nichtreproduzierbarkeit und Interessenkonflikte für Hviid et al. Wir vermuten ferner, dass Forscher, die treu dem status quo einer Impforthodoxie dienen, wissen, wie man Studien gestaltet, um die gewünschten Ergebnisse zu erzielen. Darüber hinaus veranschaulichen wir weiter, dass die Schlussfolgerung von Hviid et al. nicht auf den Impfplan für Kinder der CDC verallgemeinert werden kann, dessen wesentliche Merkmale so vielen Meinungsführern, Regulierungsbehörden, Mainstream-Medien und Berufsverbänden in den USA unbekannt geblieben sind. Betrachtet man das Gesamtbild, haben sich Stereotypisierung, soziale Stigmatisierung, Ächtung, Herablassung und Polarisierung von Eltern, die sich dafür entscheiden, ihre Kinder nicht impfen zu lassen, in der Nach-COVID-19-Ära nur noch verschärft und intensiviert. Wir würden entgegnen, dass Gesundheitsfreiheit, elterliche Autonomie und eine offene, ehrliche und ehrliche wissenschaftliche Debatte, nicht Konsens oder Zensur, die einzigen Wege sind, um echte Fortschritte zu erzielen, die unseren Kindern, Familien und der Gesellschaft als Ganzes wirklich dienen. Auf dieser Grundlage würden wir ein Moratorium für die Stigmatisierung und Dichotomisierung der Ungeimpften, der Impfgeschädigten und der Impfkritiker sowie ein Ende der Impfpflicht für Kinder bei der Einschulung vorschlagen.
Stichworte: MMR-Impfung; Autismus-Spektrum-Störung; Beobachtungsstudien; genetische Anfälligkeit; Interessenkonflikte
Copyright: Dieser Open-Access-Artikel wird unter einer Creative Commons CC BY 4.0-Lizenz veröffentlicht, die den kostenlosen Download, die Verteilung und die Wiederverwendung ermöglicht, sofern der Autor und der Vordruck in jeder Wiederverwendung zitiert werden.
1. Einleitung
Im 21. Jahrhundert sind schwere Erkrankungen wie Masern, Mumps und Röteln (MMR) in den USA allesamt relativ selten [1–3]; es handelt sich bei allen um leichte, kurzlebige, aber behandelbare Infektionskrankheiten. Komplikationen treten am häufigsten bei Kindern mit Komorbiditäten auf oder die allgemein unter schlechten sanitären Bedingungen, unzureichender Abfallentsorgung und Wasserversorgung, Armut und Entbehrung leiden. Tatsächlich erklärte das CDC im Jahr 2000 die endemischen Masern [4] und 2004 die Röteln für ausgerottet [5]. Dies wurde von Papania et al. bestätigt, die seit 2001 eine Inzidenz von weniger als 1 Fall pro 1.000.000 für Masern und seit 2004 von 1 Fall pro 10.000.000 für Röteln melden [6]. Obwohl Mumps in den USA nach wie vor endemisch sind, berichten Tappe et al. 4,54 Fälle pro 100.000 Personen im Jahr 2019 und 0,67 pro 100.000 Personen im Jahr 2023 wurden gemeldet [7]. Allerdings wurden 2006 mehrere Mumpsausbrüche in den USA [8] (≈2,2 pro 100.000) und Kanada [9] (≈75,6 pro 100.000 bei Jugendlichen) in stark geimpften Bevölkerungen gemeldet [10,11]. Erkrankungen durch MMR sind angesichts des beispiellosen Anstiegs chronischer und Autoimmunerkrankungen bei der pädiatrischen Bevölkerung kaum von Bedeutung. Schätzungen zufolge wird in den USA beispielsweise bei 1 von 36 Kindern eine Autismus-Spektrum-Störung (ASD) [12], bei 1 von 10 eine Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) [13], bei 1 von 12 Asthma [14], bei 1 von 4 eine Nahrungsmittelallergie [15] und bei 1 von 5 eine oder mehrere chronische Erkrankungen [16] diagnostiziert.
Impfstoffe werden als einer der größten medizinischen Fortschritte der letzten 160 Jahre gefeiert [17]. Tatsächlich wird die MMR-Impfung als Hauptursache für das Aussterben der MMR-Infektion in der westlichen Welt bezeichnet. Doch wie Guyer et al. [18] erörtern, „fanden fast 90 % des Rückgangs der Sterblichkeitsraten durch Infektionskrankheiten bei Kindern in den USA vor 1940 statt, als nur wenige Antibiotika oder Impfstoffe verfügbar waren“. Daher „ist die Impfung nicht für den eindrucksvollen Rückgang der Sterblichkeitsraten in der ersten Hälfte des Jahrhunderts verantwortlich“. Darüber hinaus gibt es eindeutige Belege für die Dauerhaftigkeit und Langlebigkeit der natürlichen Immunität im Vergleich zur Impfung [19–21]. Dies hat auch weitere Auswirkungen auf Säuglinge, deren früher Schutz auf einer passiven mütterlichen Immunität über die Plazenta oder postnatal über die Muttermilch beruht [22–24]. Darüber hinaus können natürliche Infektionen im Kindesalter, wie Masern und Mumps, die normale Entwicklung des Immunsystems fördern. Es gibt Berichte über schützende Effekte gegen Parkinson [25], chronische lymphatische Leukämie [26], Herz-Kreislauf-Erkrankungen [27], follikuläres B-Zell-Non-Hodgkin-Lymphom [28] und Allergien [29,30]. Der Nachweis, dass das Überleben einer Maserninfektion positive Effekte über den lebenslangen Schutz vor Masernerkrankungen hinaus mit sich bringt, zeigt weiter, dass politische Entscheidungsträger die natürliche Immunität als Opportunitätskosten der Impfung betrachten müssen. Es unterstreicht auch die Notwendigkeit langfristiger Studien, in denen ein breites Spektrum an gesundheitlichen Folgen, einschließlich der Gesamtmortalität, zwischen vollständig geimpften und vollständig ungeimpften Kindern verglichen wird [31].
Im Jahr 2013 berichteten Demicheli et al. [32] in einem Cochrane Collaboration Research Review über signifikante Hinweise auf unerwünschte Ereignisse im Zusammenhang mit MMR-Impfstoffen. Obwohl die Wissenschaftler keine statistische Bestätigung der Existenz oder eines verlässlichen Zusammenhangs zwischen MMR-Impfungen und ASD-Diagnosen vorlegten, berichteten sie von der Feststellung, dass „die problematische interne Validität einiger der einbezogenen Studien und die in den Studien vorhandenen Verzerrungen (Auswahl, Durchführung, Schwund, Erkennung und Berichterstattung) unser Vertrauen in ihre Ergebnisse beeinflussten“; dass „das Design und die Berichterstattung über die Sicherheitsergebnisse in MMR-Impfstoffstudien, sowohl vor als auch nach der Markteinführung, weitgehend unzureichend sind“; und dass „die Hinweise auf unerwünschte Ereignisse nach der Immunisierung mit dem MMR-Impfstoff nicht von seiner Rolle bei der Prävention der Zielkrankheiten getrennt werden können“. Tatsächlich weist die MMR-Impfung, wie von Miller [33] erörtert, viele dokumentierte Sicherheitsdefizite auf, die den wohlbekannten Vorteilen entgegenwirken. So wird der MMR-Impfung beispielsweise ein erhöhtes Risiko für Notaufnahmeeinweisungen, Krampfanfälle und Thrombozytopenie, eine schwere Blutungsstörung, zugeschrieben.
Die US-Regierung und die Mainstream-Medien verbreiten routinemäßig die Behauptung, wissenschaftliche Studien hätten schlüssig bewiesen, dass Impfstoffe keine Autismus-Spektrum-Störung (ASS) verursachen können. Die Centers for Disease Control and Prevention (CDC) erklären auf ihrer Website autoritär, dass „Impfstoffe keinen Autismus verursachen“ [34]. Zur Untermauerung ihrer kühnen Behauptung zitiert die Behörde mehrere Berichte, die vom Institute of Medicine (IoM) (jetzt National Institute of Medicine) in Auftrag gegeben wurden: 2004 („Immunization Safety Review“) [35], 2011 („Effects of Vaccines: Evidence and Causality“) [36] und 2013 („The childhood immunization schedule and safety“) [37]. Der Bericht von 2004 kam zu dem Schluss, „dass die Evidenz dafür spricht, einen kausalen Zusammenhang zwischen MMR-Impfstoff und Autismus abzulehnen“ (S. 7). Derselbe IoM-Bericht räumt jedoch „die Möglichkeit ein, dass MMR bei einer kleinen Zahl von Kindern zu Autismus beitragen könnte, da die epidemiologischen Studien nicht präzise genug waren, um seltene Fälle zu beurteilen; es war zum Beispiel möglich, dass epidemiologische Studien bei einer Untergruppe der Bevölkerung mit einer genetischen Prädisposition für Autismus keinen Zusammenhang zwischen Autismus und MMR-Impfung feststellen würden. Die biologischen Modelle für einen Zusammenhang zwischen MMR und Autismus wurden nicht aufgestellt, aber auch nicht widerlegt“ (S. 4). Obwohl der IoM-Bericht von 2004 den Untertitel „Impfstoffe und Autismus“ trug und fälschlicherweise so ausgelegt wurde, als seien alle Impfstoffe von der Autismus-Epidemie freigestellt, entschied das Komitee nur über einen einzigen Impfstoff und einen einzigen Inhaltsstoff, nämlich den MMR-Impfstoff bzw. die Verwendung von Thiomersal. Bezüglich des MMR-Impfstoffs sagte das Komitee: 2004 erkannte das IoM „die Möglichkeit an, dass MMR bei einer kleinen Zahl von Kindern zu Autismus beitragen könnte“ (S. 4) und dass die Art der durchgeführten Beobachtungsstudien „keinen Zusammenhang zwischen Autismus und MMR-Impfung bei einer Untergruppe der Bevölkerung mit einer genetischen Prädisposition für Autismus feststellen würde“ (S. 4). Der IoM-Bericht von 2011 kam wie der IoM-Bericht von 2004 zu dem Schluss, dass die Beweislage für die Ablehnung eines kausalen Zusammenhangs spreche; diese Schlussfolgerung basierte jedoch hauptsächlich auf vier Beobachtungsstudien, die allesamt die Möglichkeit „genetisch anfälliger Untergruppen“ nicht berücksichtigten. Der IoM-Bericht von 2013 war eine Aktualisierung früherer Berichte, die sich mit der Sicherheit des gesamten Impfplans für Säuglinge und Kinder befassten. Das Komitee stellte fest, dass „keine Studien durchgeführt wurden, die die langfristigen Auswirkungen der kumulativen Anzahl von Impfungen oder andere Aspekte des Impfplans untersuchen sollten“ (S. 5). Folglich können die Untersuchungen des IoM die Behauptung, für die das CDC sie zitiert, nicht stützen.
2. Wakefield et al. 1998
Die Hysterie in den Medien, Institutionen und der Öffentlichkeit um den MMR-Impfstoff lässt sich auf eine klinische Fallstudienstudie von Wakefield et al. aus dem Jahr 1998 an 12 Kindern mit regressiven Entwicklungsstörungen zurückführen, darunter neun mit Autismus mit ASS [38]. Im Jahr 2004, im selben Jahr, in dem das IoM seinen Bericht herausgab, in dem es zu dem Schluss kam, dass „keine überzeugenden Beweise für die Entstehung von Autismus durch MMR bei Frauen“ vorlägen, veröffentlichte The Lancet einen „Widerruf der Interpretation“ von Wakefield et al. [39], der 2010 vollständig widerrufen wurde. Dies gipfelte in dem, was im Wesentlichen als „professionelle Kastration“ des Hauptautors Andrew Wakefield und seines Co-Autors John Walker-Smith durch den britischen Journalisten Brian Deer im British Medical Journal im Jahr 2010 beschrieben werden kann [40–42]. In diesem klinischen Fallstudienbericht berichten Wakefield et al. beschreiben ein Muster entzündlicher Darmerkrankungen (Colitis und ileolymphoidnoduläre Hyperplasie) bei Kindern mit Autismus im Zusammenhang mit einer MMR-Impfung. Bemerkenswerterweise waren die Hypothesen, die die Studie aufstellte, nicht neu, obwohl sie damals als beinahe eigenwillig wahrgenommen wurden. Die vorliegende Arbeit folgte früheren Spekulationen von Wakefield und Kollegen aus dem Jahr 1994 über einen kausalen Zusammenhang zwischen dem Masernvirus [43–45] und der MMR-Impfung [46] mit Morbus Crohn. In den Schlussfolgerungen ihrer Veröffentlichung von 1998 erklärten Wakefield et al. ausdrücklich: „Wir konnten keinen Zusammenhang zwischen der Masern-, Mumps- und Rötelnimpfung und dem beschriebenen Syndrom nachweisen. Wir haben bei Kindern chronische Enterokolitis festgestellt, die möglicherweise mit einer neuropsychiatrischen Funktionsstörung in Zusammenhang steht. In den meisten Fällen traten die Symptome nach einer Masern-, Mumps- und Rötelnimpfung auf.“ Sie schlagen jedoch vor: „Weitere Untersuchungen sind erforderlich, um dieses Syndrom und seinen möglichen Zusammenhang mit dieser Impfung zu untersuchen.“ Bis heute ist ein kausaler Zusammenhang zwischen ASD und MMR-Impfung noch immer stark umstritten. Doch fast 26 Jahre nach der Veröffentlichung der Studie gibt es, wie Wakefield und Kollegen Anfang der 2000er Jahre spekulierten [47,48], substanzielle Beweise, die nicht nur einen korrelativen, sondern auch einen kausalen Zusammenhang zwischen Darmentzündung, Darmpathologie und der Darm-Hirn-Achse in der Ätiologie, Pathogenese und Pathophysiologie von ASD belegen [49]. Tatsächlich empfahl im Jahr 2010 ein Expertengremium der American Association of Pediatrics (AAP), „einer Organisation von 60.000 Kinderärzten“ [50], dringend weitere Untersuchungen zur Rolle gastrointestinaler Anomalien bei Kindern mit ASD [51].
Die Kontroverse um MMR und ASD kann und sollte weiter auf eine soziale Bewegung von Eltern zurückgeführt werden, die sich aufgrund ihrer Besorgnis über die MMR-Impfung mobilisierten und die Anfang der 1990er Jahre in Großbritannien begann. Die Eltern berichteten von einer entwicklungsmäßig normalen Kindheit mit plötzlichen Regressionen etwa in der Mitte des zweiten oder vierten Lebensjahres [52]. Die Kinder ziehen sich zurück, und später werden Symptome als Teil des autistischen Spektrums diagnostiziert, zusammen mit schweren und schmerzhaften Darmproblemen. Im Hinblick auf den Zeitpunkt brachten viele Eltern Entwicklungsregressionen und autistische Symptome mit der MMR-Impfung in Verbindung. Viele Eltern berichteten von medizinischem Gaslighting hinsichtlich des Leidens ihrer Kinder oder von individuellen Erfahrungen mit der Entwicklung von Symptomen. Gaslighting wird hier definiert als „Missbrauch, der darauf abzielt, die Opfer an ihrem Verstand sowie an der Wahrhaftigkeit und Legitimität ihrer Ansichten und Gefühle zweifeln zu lassen“ [53]. Die Notlage der Patienten wurde noch dadurch verschärft, dass ihre Berichte von staatlicher und gesellschaftlicher Seite nur begrenzt anerkannt wurden. Medizinisches Gaslighting ist bei MMR und ASD nichts Neues, und es wächst die Erkenntnis, dass das moderne allopathische „Diagnose-Protokoll-Verschreibung-Paradigma“ eine größere Kluft zwischen Arzt und Patient geschaffen hat [54]. Tatsächlich scheint medizinisches Gaslighting immer häufiger vorzukommen, insbesondere bei Krankheiten, die angeblich durch Impfstoffe verursacht [55] oder umstritten sind [56]. Das Gaslighting und die geteilten Erfahrungen und das Verständnis von Eltern, die von Verletzungen und Entwicklungsverzögerungen im Zusammenhang mit der MMR-Impfung berichteten, führten letztendlich zu einer „Eltern-Wakefield-Allianz“. Ihre Medienberichterstattung wurde zu einem ernsthaften Problem für Wissenschaftler und politische Entscheidungsträger, die in Großbritannien, Europa und den USA in die öffentliche Gesundheit und Impfungen involviert sind. Leach stellt dies als einen Gegensatz zwischen individuellem bzw. väterlichem und öffentlichem Engagement dar [57]. Eltern waren in erster Linie um die ihrer Ansicht nach durch Impfstoffe geschädigte Gesundheit ihrer Kinder besorgt. Regierungspolitiker und ihre unterstützenden wissenschaftlichen Netzwerke hatten institutionelle Verpflichtungen zur fortgesetzten Integrität eines Impfprogramms mit seinen öffentlichen Verpflichtungen und Imperativen auf Bevölkerungsebene. Erwähnt werden müssen auch die Interessen der Pharmaunternehmen [58], d. h. das „Blockbuster“-Monopol und die Gewinnspanne für ihre Aktionäre, maximiert durch Millionenausgaben für Marketing und Lobbyarbeit für ihre Produkte [59].
Wissenschaftliche Spekulationen, Kontroversen, strafrechtliche Vorwürfe und Nuancen [60,61] im Zusammenhang mit dem Fall von Wakefield et al. stehen sicherlich nicht im Mittelpunkt dieser Studie. Die oben hervorgehobene Gehässigkeit, Hysterie und Polarisierung der Perspektiven bilden jedoch den Hintergrund, zusammen mit einer Kaskade von Beobachtungsstudien, die den Zusammenhang zwischen MMR-Impfung und ASD untersuchen [62,63]. Die Debatte dreht sich teilweise um die Bedeutung, die epidemiologischen im Gegensatz zu klinischen Beweisen zugeschrieben wird, und um den Status, der den Beobachtungen und väterlichen Instinkten der Eltern zugeschrieben wird [64], und gipfelte 2019 in der Veröffentlichung von Hviid et al.
3. Hviid et al. 2019
Im Jahr 2019 wurde eine Beobachtungsstudie von Hviid et al. [65] veröffentlicht, die von den Mainstream-Medien, insbesondere in den USA, gefeiert wurde, da sie unwiderlegbar beweise, dass der MMR-Impfstoff nicht einmal bei „genetisch anfälligen Kindern“ Autismus verursachen könne. Die Studie wurde am 5. März 2019 in der Fachzeitschrift Annals of Internal Medicine veröffentlicht und trug den Titel „Masern-, Mumps- und Röteln-Impfung und Autismus: Eine landesweite Kohortenstudie“. Autoren waren Anders Hviid, Jørgen Vinsløv Hansen, Morten Frisch und Mads Melbye. Die AAP behauptete: „Eine andere Studie hat bestätigt, dass Kinder, die einen Masern-, Mumps- und Röteln-Impfstoff (MMR) erhalten, keinem erhöhten Autismusrisiko ausgesetzt sind“ und dass die Ergebnisse „auch für geimpfte Kinder gelten, bei denen ein Geschwisterkind mit Autismus diagnostiziert wurde. Bei Mädchen war das Autismusrisiko bei den Geimpften geringer“ [66]. Hier einige weitere anschauliche Beispiele dafür, wie die US-Mainstream-Medien über die Studie von Hviid et al. berichteten:
- Eine Schlagzeile von CNN lautete: „MMR-Impfstoff verursacht keinen Autismus, bestätigt eine weitere Studie.“ CNN betonte, dass „der größte Beitrag der Studie die Einbeziehung von Kindern mit Autismusrisiko war“, und berichtete, dass Impfstoffe „das Autismusrisiko nicht erhöhen und bei gefährdeten Kindern keinen Autismus auslösen“ [67].
- Eine Schlagzeile von National Public Radio (NPR) lautete ähnlich: „Eine große Studie liefert weitere Beweise dafür, dass MMR-Impfstoffe keinen Autismus verursachen.“ In diesem Artikel wurde der Hauptautor Anders Hviid zitiert, der schlüssig feststellte, dass „MMR keinen Autismus verursacht“. Laut NPR hat die Studie „kein erhöhtes Risiko bei Untergruppen von Kindern festgestellt, die möglicherweise ungewöhnlich anfällig für Autismus sind, wie etwa solche, deren Bruder oder Schwester an dieser Störung leiden“ [68].
- Die Überschrift eines LiveScience-Artikels über die Studie lautete: „Bestätigt: Kein Zusammenhang zwischen Autismus und Masernimpfung, nicht einmal bei ‚gefährdeten‘ Kindern“ [69].
- Eine Schlagzeile in der New York Times verkündete: „Noch einmal mit Big Data: Masernimpfung verursacht keinen Autismus“ [70].
- „Eine weitere umfangreiche Studie zeigt, dass Masernimpfung keinen Autismus verursacht“, lautete die Überschrift eines Healthline-Artikels, in dem Co-Autor Mads Melbye mit den Worten zitiert wurde: „Es ist Zeit, die Hypothese zu begraben, dass MMR Autismus verursacht“ [71].
- MedicalNewsToday berichtete: „MMR-Impfung verursacht keinen Autismus, nicht einmal bei den am stärksten gefährdeten Kindern“ [72].
- „Studie bestätigt erneut keinen Zusammenhang zwischen MMR-Impfung und Autismus“, lautete die Schlagzeile eines Artikels im Psychiatry Advisor, in dem behauptet wurde, die Studie habe gezeigt, dass die Impfung „bei anfälligen Kindern keinen Autismus auslöst“ [73].
- Das Magazin New Yorker stellte fest: „Die Wissenschaft ist sich in diesem Punkt einig, soweit es die Wissenschaft überhaupt ist, wenn es darum geht, etwas Negatives zu beweisen“ [74].
Die Medien charakterisierten die Studie als Ablehnung der Hypothese eines kausalen Zusammenhangs zwischen MMR-Impfung und Autismus bei „anfälligen Kindern“. Wie jedoch kurz erläutert, schlossen Hviid et al. Kinder mit mehreren genetischen Erkrankungen ausdrücklich aus, weil diese Erkrankungen mit einem erhöhten Autismusrisiko verbunden sind. In keinem dieser Medienberichte wurde den Lesern diese wichtige Tatsache vermittelt. Ebenso wenig gab es seitens der Medien oder der AAP die geringste kritische Prüfung der Methodik, Ergebnisse und Schlussfolgerungen der Studie. Im Gegensatz zu dem, was uns die Mainstream-Medien erzählt haben, kann die Studie von Hviid et al., wie in diesem kritischen Kommentar erörtert, nicht schlüssig beweisen, dass der MMR-Impfstoff bei „anfälligen Kindern“ kein Autismusrisiko verursacht. Darüber hinaus widerlegt sie ganz sicher nicht die Hypothese, dass der MMR-Impfstoff oder Impfstoffe, die gemäß dem Impfplan der CDC verabreicht werden, zur Entwicklung von Autismusrisiko bei anfälligen Kindern beitragen können. Tatsächlich gibt es in der Studie von Hviid et al. erhebliche Nuancen, deren kritische Betrachtung zeigt, dass sie nicht gewissenhaft angewendet wurde, um diese Hypothese zu testen, und sie daher unmöglich widerlegt haben kann.
4. Studienübersicht
4.1. Ziele
Eine vorangegangene retrospektive Kohortenstudie (in Dänemark zwischen 1991 und 1998 geborene Kinder) von Madsen und Kollegen, darunter Hviid und Melbye, wurde 2002 im New England Journal of Medicine (NEJM) [75] unter dem Titel „Eine bevölkerungsbasierte Studie über Masern-, Mumps- und Rötelnimpfung und Autismus“ veröffentlicht. Unter Verwendung analoger Methoden und Datenquellen kamen Madsen et al. 2002 wie Hviid et al. zu dem Schluss, dass „diese Studie starke Beweise gegen die Hypothese liefert, dass die MMR-Impfung Autismus verursacht.“ Hviid et al. verwies auf diese frühere Studie und erklärte: „In dieser Studie wollten wir den Zusammenhang erneut in einer aktuelleren und nicht überlappenden Kohorte dänischer Kinder untersuchen, die aufgrund der größeren Zahl an Kindern, mehr Fällen und einer längeren Nachbeobachtung über eine höhere statistische Aussagekraft verfügt“, und „bewerten, ob die MMR-Impfung das Autismusrisiko bei Kindern, Untergruppen von Kindern oder in der Zeit nach der Impfung erhöht.“ Die Autoren weisen auf die Kritik hin, dass die frühere Studie „die Bedenken nicht berücksichtigt hat, dass die MMR-Impfung bei bestimmten Gruppen mutmaßlich anfälliger Kinder Autismus auslösen könnte“. Sie behaupteten, dass ihre neue Studie „diese Bedenken im Detail anspricht“, indem sie „das Autismusrisiko nach der MMR-Impfung in Untergruppen von Kindern untersucht, die nach umweltbedingten und familiären Autismus-Risikofaktoren definiert wurden“.
4.2. Studiendesign, Methodik und Demografie sowie Schlussfolgerungen
Die Autoren analysierten Daten von 663.236 Kindern, die zwischen dem 1. Januar 1999 und dem 31. Dezember 2010 in Dänemark als Kind in Dänemark geborener Mütter geboren wurden. Von diesen Kindern wurden 5.775 ausgeschlossen, sodass sich eine Kohorte von 657.461 Kindern ergab. Der Beobachtungszeitraum erstreckte sich vom ersten Lebensjahr bis zum 31. August 2013, sodass die frühgeborenen Kinder am Ende der Nachbeobachtung 14 Jahre alt waren, während die spätgeborenen erst zwei Jahre alt waren. Die Gesamtzahl der Kinder, die bis zum Ende der Studie weiterbeobachtet wurden, betrug 650.943, und von diesen Kindern hatten zum Zeitpunkt des Endes der Nachbeobachtung 6.517 (1 %) eine Autismusdiagnose erhalten. Das durchschnittliche Alter bei der Autismusdiagnose in ihrer Studienpopulation lag bei 7,22 Jahren für Kinder, die zwischen Januar 1994 und 1999 in Dänemark geboren wurden. Parner et al. Im Gegensatz dazu berichteten Hviid et al. im Jahr 2008, dass das durchschnittliche Alter bei der Diagnose von Autismus in Dänemark 5 – 6 Jahre betrug, wobei während des Studienzeitraums ein Rückgang des Diagnosealters beobachtet wurde [76]. Insgesamt war die von Hviid et al. untersuchte Bevölkerung zu etwa 95 % „geimpft“, mit einem durchschnittlichen Impfalter von 1,34 Jahren (≈ 16 Monaten). Unter den Kindern mit Autismus waren 5.992 (92 %) „geimpft“ und 525 (8 %) „ungeimpft“. Hviid et al. fassen ihre Methodik wie folgt zusammen: „Eine Überlebensanalyse der Zeit bis zur Autismusdiagnose mit einer Cox-proportionalen Risikoregression wurde verwendet, um die Risikoverhältnisse für Autismus je nach MMR-Impfstatus zu schätzen, mit Anpassungen für Alter, Geburtsjahr, Geschlecht, andere Impfungen in der Kindheit, autistische Geschwistervorgeschichte und Autismusrisikofaktoren (basierend auf einem Krankheitsrisikoscore).“
Das wichtigste Ergebnis der Hauptanalyse der Studie war, dass „geimpfte“ Kinder kein höheres Autismusrisiko hatten als „ungeimpfte“ Kinder. Wie in der Zusammenfassung angegeben, „ergab der Vergleich von MMR-geimpften mit MMR-ungeimpften Kindern eine vollständig angepasste Autismus-Hazard-Ratio von 0,93 (95% KI, 0,85 bis 1,02).“ Abbildung 3 von Hviid et al. fasst HRs, Konfidenzintervalle und p-Werte der Korrelation weiter zusammen. Mit Ausnahme der reduzierten Assoziation von Autismus und der MMR-Impfung bei Mädchen (HR = 0,79, 95% KI = 0,64 – 0,97) waren alle p-Werte > 0,05, was auf keine signifikante Assoziation hinweist. Auf dieser Grundlage kamen die Autoren zu den gewagten Schlussfolgerungen: „Die Studie unterstützt nachdrücklich, dass die MMR-Impfung das Autismusrisiko nicht erhöht, bei anfälligen Kindern keinen Autismus auslöst und nicht mit einer Häufung von Autismusfällen nach der Impfung verbunden ist. Sie ergänzt frühere Studien durch erhebliche zusätzliche statistische Aussagekraft und indem sie Hypothesen zu anfälligen Untergruppen und Häufungen von Fällen behandelt.“ Es gibt jedoch zahlreiche Gründe, warum ihre Ergebnisse diese gewagten Schlussfolgerungen nicht stützen können und sollten, darunter erhebliche Studienmängel, zahlreiche Unstimmigkeiten und ungeklärte Analysen; hervorstechende Merkmale, die jedoch den Aufsichtsbehörden, Verbänden und Mainstream-Medien in den USA entgangen sind.
5. Fehler im Studiendesign
5.1. Irreführende Definition von „genetischer Anfälligkeit“, Ausschluss von Kindern mit hoher Anfälligkeit und unzureichende Stichprobengröße
Einer der Kritikpunkte an den Studien, die das CDC zur Untermauerung seiner Behauptung zitiert, dass „Impfstoffe keinen Autismus verursachen“, ist, dass sie die Möglichkeit „anfälliger Subpopulationen“ nicht berücksichtigen. Hviid et al. erkennen dies an und stellen fest: „Es fehlten spezifische Definitionen anfälliger Untergruppen.“ Die Autoren verweisen auf Jain et al. [80] und folgen dem Beispiel von Jain et al., indem sie „genetische Anfälligkeit“ lediglich als „eine Geschwistergeschichte mit Autismus“ zum Zeitpunkt des Studienbeginns definieren. Wenn also ein Kind ein autistisches Geschwisterkind hätte, dieses aber erst diagnostiziert worden wäre, nachdem das Kind in die Studie aufgenommen worden war, wäre das Kind fälschlicherweise als nicht „genetisch anfällig“ eingestuft worden. Ebenso wäre ein Kind, das eine genetische oder umweltbedingte Anfälligkeit hätte, aber keine Geschwister hätte, fälschlicherweise eingestuft worden. Bei 49 % der untersuchten Kinder wurde einfach aufgrund der Tatsache, dass sie Einzelkinder waren, eine „genetische Anfälligkeit“ festgestellt, da 319.936 der insgesamt 657.461 Kinder keine Geschwister hatten.
Das zentrale Dogma, dass Autismus eine stark vererbbare genetische Krankheit ist, wird diskutiert. Im Jahr 2011 berichteten Hallmayer et al. [81] in der bis dato größten Zwillingsstudie von einer moderaten genetischen Erblichkeit von 37-38 % [82]. Später im Jahr 2014 kamen Gaugler et al. [83] anhand einer epidemiologischen Stichprobe aus Schweden zu dem Schluss, dass die genetische Architektur von Autismus eine Erblichkeit im engeren Sinne von ≈52,4 % aufweist, wobei der Großteil auf die häufige Variation und seltene De-novo-Mutationen zurückzuführen ist. In Anbetracht der aktuellen Beweise für eine moderate genetische Erblichkeit bei Autismus würde ein Kind, das eine genetische Anfälligkeit und ein oder mehrere Geschwister hätte, aber keines der Geschwister das genetische Merkmal oder den Umweltauslöser teilt, fälschlicherweise als nicht „genetisch anfällig“ eingestuft werden.
Darüber hinaus schlossen Hviid et al. – und dies steht im Widerspruch zu den erklärten Zielen der Studie – 620 Kinder aus, bei denen im ersten Lebensjahr eine der folgenden genetischen Störungen diagnostiziert worden war: Neurofibromatose, tuberöse Sklerose, Angelman-Syndrom, Fragiles-X-Syndrom, Prader-Willi-Syndrom, Down-Syndrom und DiGeorge-Syndrom –, obwohl sie ihre Studie damit anpreisen, sie sei darauf ausgelegt, „die Bedenken auszuräumen, dass die MMR-Impfung bei bestimmten Gruppen mutmaßlich anfälliger Kinder Autismus auslösen könnte“.
Alle diese Erkrankungen weisen eine höhere Komorbiditätsrate mit Autismus auf [84–90]. Obwohl sie ihre Gründe für diese Ausschlusskriterien nicht erklärten, war ihre Arbeitsannahme vermutlich folgende: Wenn bei diesen Kindern später Autismus diagnostiziert wurde, dann lag dies an ihrer Grunderkrankung und nicht an der Impfung. Dieser Syllogismus ist jedoch ein Trugschluss, der nicht schlüssig ist; die Schlussfolgerung ergibt sich nicht aus der Prämisse. Tatsächlich behandelten Hviid et al. all diese Erkrankungen als konkurrierende Hypothesen. Man könnte behaupten, sie hätten sie als potenzielle Risikofaktoren oder Indikatoren epigenetischer Anfälligkeiten behandeln sollen, die diese Kinder für Impfschäden prädisponieren könnten, die sich als Symptome von Autismus manifestieren. Indem die Autoren diese Kinder ausschlossen, handelten sie daher direkt entgegen ihrem erklärten Ziel, zu untersuchen, ob „Impfungen Autismus in bestimmten Gruppen mutmaßlich anfälliger Kinder auslösen könnten“.
Wie wir gesehen haben, priesen die Medien diese Studie als „groß“ an und verwiesen auf eine Studienpopulation von 657.461 Personen. Was die Medien jedoch konsequent versäumten, darauf hinzuweisen, ist, dass nur eine kleine Zahl der Autorendefinition von „genetisch anfällig“ entsprach, wobei nur 838 (0,13 %) Kinder das Kriterium erfüllten, ein Geschwister mit Autismus zu haben. Anschließend ergab die berichtete HR für „Geschwister mit Autismus“ eine HR von 2,69 für Autismus (95 % KI 0,58 – 12,63) bei denen, die den MMR-Impfstoff erhielten, im Vergleich zu denen, die ihn nicht erhielten. Obwohl diese Korrelation statistisch nicht signifikant war, kann man spekulieren, dass das Ergebnis signifikant gewesen wäre, wenn die Autoren die 620 Kinder mit genetischen Störungen nicht ausgeschlossen hätten. Wir werden es nie erfahren, da die Autoren sich geweigert haben, ihre zugrunde liegenden Daten anderen Wissenschaftlern zugänglich zu machen, um ihre Ergebnisse reproduzieren zu können.
Abgesehen von genetischen Faktoren entwickelten Hviid et al. einen „Autismus-Risiko-Score“, der auf mehreren „Umwelt-Autismus-Risikofaktoren“ basiert, die sich jedoch auf „Alter der Mutter, Alter des Vaters, Rauchen während der Schwangerschaft, Entbindungsmethode, Frühgeburt, 5-Minuten-Apgar-Score, niedriges Geburtsgewicht und Kopfumfang“ beschränkten. Obwohl ein niedriger 5-Minuten-Apgar-Score, niedriges Geburtsgewicht und großer Kopfumfang auf einen sich entwickelnden Autismus-Phänotyp hinweisen können, wäre es falsch, sie als „Risikofaktoren“ in der Ätiologie oder Pathogenese von ASD zu bezeichnen. Darüber hinaus wird abgesehen vom „Rauchen während der Schwangerschaft“ keine Bewertung des Risikos durch xenobiotische Umweltschäden vorgenommen. Dies umfasst eine lange Tradition wissenschaftlicher Literatur, die viele Jahrzehnte umfasst und die Exposition gegenüber Arzneimitteln, Industriechemikalien sowie giftigen und Schwermetallen in der Ätiologie von ASD in Verbindung bringt [91]. Zukünftige Studien sollten eine strengere Risikobewertung der Exposition gegenüber Umweltgiften [92–94] und anderen sozioökonomischen Faktoren vornehmen. Wissenschaftler könnten beispielsweise einen Risiko-Score für die Belastung mit Umweltgiften entwickeln, der auf Faktoren wie dem geografischen Standort basiert, aber nicht darauf beschränkt ist. Neuere Arbeiten von Palmer et al. [95] bieten modernste Ansätze für eine strenge Bewertung chemischer Risikofaktoren und Unverträglichkeiten bei Kindern und Eltern, die an Autismus und ADHS erkranken. Dazu gehört eine vollständige Bewertung der Symptome, Unverträglichkeiten und Auswirkungen der Belastung mit Chemikalien, Nahrungsmitteln und Medikamenten auf das Leben.
Der zweite Eintrag für die Definition des Verbs „lügen“ im Merriam-Webster-Wörterbuch lautet „einen falschen oder irreführenden Eindruck erwecken“ [96]. Wir würden daraus schließen, dass Hviid et al. genau dies taten, als sie die öffentliche Botschaft verbreiteten, dass ihre Studie bewiesen habe, dass der MMR-Impfstoff „nicht einmal bei Kindern Autismus verursacht, die einem höheren Autismusrisiko ausgesetzt sind“ oder „genetisch anfällig“ sind. Tatsächlich definierten Hviid et al. „genetische Anfälligkeit“ und schlossen Kinder ein, die ihrer Definition entsprachen. Wie oben dargelegt, fehlt einer solchen „Ad-hoc“-Definition von „genetischer Anfälligkeit“ jedoch die wissenschaftliche Genauigkeit und sie ist unzureichend und irreführend.
5.2. Fehlende Kontrolle des „Healthy User Bias“
5.2.1. Jain et al.
In früheren Studien zur Impfbereitschaft wurde ein „Healthy User Bias“ hervorgehoben [97–99]. In diesem Szenario neigen Eltern von Kindern, die schon in jungen Jahren Symptome zeigen oder die ein älteres MMR-geimpftes Geschwisterkind mit Autismus, Entwicklungsverzögerungen oder anderen chronischen Erkrankungen haben, eher dazu, auf die MMR-Impfung zu verzichten, wodurch Korrelationen zugunsten des Fehlens eines Zusammenhangs verzerrt werden. Dieser „Healthy User Bias“ wurde von Hviid et al. anerkannt, die auf die Studie von Jain et al. verweisen [100], in der „niedrigere MMR-Aufnahmeraten bei Kindern mit betroffenen Geschwistern festgestellt wurden“. In einer 2015 veröffentlichten Studie untersuchten Jain et al. das Auftreten von Autismus nach MMR-Impfstatus bei US-amerikanischen Kindern mit älteren Geschwistern mit und ohne Autismus. Jain et al. ziehen daraus die Schlussfolgerung war, dass „in dieser großen Stichprobe privat versicherter Kinder mit älteren Geschwistern die MMR-Impfung nicht mit einem erhöhten Autismusrisiko verbunden war, unabhängig davon, ob die älteren Geschwister Autismus hatten oder nicht.“ Aufgrund der geringeren Impfbereitschaft bei Kindern, die aufgrund „genetischer Faktoren“ einem höheren Autismusrisiko ausgesetzt waren, müssten solche Schlussfolgerungen neu bewertet werden.
Zur Veranschaulichung: Wie Jain et al. ausführlich beschreiben, betrug die MMR-Impfrate bei Kindern mit nicht betroffenen Geschwistern 84 % im Alter von 2 Jahren und 92 % im Alter von 5 Jahren, während sie bei Kindern mit autistischen älteren Geschwistern 73 % im Alter von 2 Jahren und 86 % im Alter von 5 Jahren betrug. Das deutet darauf hin, dass Eltern, deren erstes Kind nach der MMR-Impfung mit Autismus diagnostiziert wird, ihr zweites Kind weniger wahrscheinlich impfen lassen, aus Angst, dies könnte zur Entwicklung von Autismus beim jüngeren Geschwisterkind beitragen. Ebenso könnten Eltern, die frühe Entwicklungsverzögerungen bemerken, auf die MMR-Impfung verzichten, aus Angst, diese könnte zur Entwicklung von Autismus beitragen. In Anbetracht der Tatsache, dass bei Kindern mit autistischen älteren Geschwistern niedrigere relative Risikoschätzungen (RR) beobachtet wurden als bei Kindern mit nicht betroffenen Geschwistern, heißt es in den eigenen Worten der Autoren: „Es ist zum Beispiel möglich, dass dieses Muster durch selektive Entscheidungen der Eltern in Bezug auf die MMR-Impfung bedingt ist, d. h. Eltern, die bei ihren Kindern soziale oder kommunikative Verzögerungen bemerken, entscheiden sich, auf die Impfung zu verzichten. Da Kinder mit erkennbaren Entwicklungsverzögerungen als Gruppe wahrscheinlich einem höheren Risiko von Autismus ausgesetzt sind, könnte eine solche Selektivität dazu führen, dass einige Kinder mit höherem Risiko nicht der Impfung ausgesetzt werden … Es ist auch plausibel, dass die Eltern betroffener älterer Geschwister besonders auf Entwicklungsverzögerungen bei ihren jüngeren Kindern achten und sich entscheiden, die Impfung zu verzögern.“ Jain et al. stellten daher die begründete Hypothese auf, dass Familien mit einem bereits von Autismus betroffenen Kind besonders besorgt über dies bei jüngeren Geschwistern sein könnten, was zu einer niedrigeren Impfrate bei „genetisch anfälligen Kindern“ führen würde. Darüber hinaus stellten Jain et al. eine negative Korrelation zwischen der Autismusrate bei Kindern mit einem autistischen älteren Geschwisterkind und der MMR-Impfung fest, obwohl dies nicht statistisch signifikant ist. Anstatt auf eine Schutzwirkung des Impfstoffs hinzuweisen, würden wir spekulieren, dass dies ein weiteres Indiz für eine Störgröße durch „gesunde Benutzervoreingenommenheit“ wäre. Dies ist ein inhärentes Störfaktorrisiko bei allen Beobachtungsstudien, das berücksichtigt und kontrolliert werden muss.
5.2.2. Hviid et al.
Wir wissen, dass Hviid et al. sich des „Health User Selection Bias“ bewusst waren, weil sie Jain et al. zitierten und deren Feststellung einer geringeren Impfbereitschaft unter „anfälligen Kindern“ anerkannten. Sie haben dies jedoch nicht berücksichtigt. Tatsächlich bestätigten Hviid et al., dass Kinder mit autistischen Geschwistern eine 7,32-mal höhere HR (95 % KI 5,29 – 10,12) für Autismus hatten als Kinder mit nicht autistischen Geschwistern. Sie anerkannten auch die Feststellung von Jain et al., dass Kinder mit einem älteren autistischen Geschwister weniger wahrscheinlich den MMR-Impfstoff erhielten. Basierend auf ihrer Analyse der dänischen Studienbevölkerung behaupteten sie jedoch, eine Impfrate von 95,19 % und „keine nennenswerten Unterschiede in der Impfbereitschaft je nach … Autismusvorgeschichte bei Geschwistern“ beobachtet zu haben. Bei genauerer Betrachtung der Daten sind alternative Interpretationen erforderlich. Bei Mädchen gelangten die Autoren unbegründet zu dem Schluss, dass der Impfstoff schützt, und behaupteten, dass die MMR-Impfung „das Autismusrisiko bei Mädchen verringert“. Wir würden vermuten, dass der insgesamt negative Zusammenhang (HR = 0,79, 95 % CI 0,64 – 0,97) vielmehr darauf zurückzuführen sein könnte, dass Mädchen mit „höherem Risiko“ den Impfstoff seltener erhalten. Aus der Tabelle der Bevölkerungsmerkmale der Studie geht hervor, dass 838 der Kinder in der Studienbevölkerung ein Geschwisterkind mit Autismus hatten, von denen 759 (90,6 %) MMR-geimpft waren und 79 (9,4 %) nicht. Während also in der allgemeinen Studienbevölkerung nur 4,8 % „ungeimpft“ waren, war der Anteil der Ungeimpften unter den „genetisch anfälligen“ Kindern fast doppelt so hoch. Abbildung 3 von Hviid et al. zeigt weiter, dass von diesen 838 „genetisch anfälligen Kindern“ 37 (4,4 %, oder 1 von 23) mit Autismus diagnostiziert wurden. Wie bereits erwähnt, weist die für diese Kohorte gezeigte HR auf ein 2,69-mal höheres Autismusrisiko bei „geimpften“ Kindern im Vergleich zu „ungeimpften“ hin. Von den 37 mit Autismus diagnostizierten Kindern waren 32 „geimpft“ und 5 „ungeimpft“. Daher hatten 4,2 % der anfälligen geimpften Kinder eine Autismusdiagnose im Vergleich zu 6,3 % der anfälligen ungeimpften Kinder, was auf eine mögliche Zusammenlegung von Kindern mit „höherem Risiko“ in der „ungeimpften“ Gruppe hindeutet.
Um die Frage noch aus einem anderen Blickwinkel anzugehen: 759 der 625.842 „geimpften“ Kinder hatten ein autistisches Geschwisterkind, verglichen mit 79 der 31.619 „ungeimpften“ Kinder. Daher waren 0,12 % der „geimpften“ Kinder „genetisch anfällig“ im Vergleich zu 0,25 % der „ungeimpften“ Kinder. Die „ungeimpften“ waren also gemäß der Definition des Autors doppelt so wahrscheinlich „genetisch anfällig“. Darüber hinaus zeigt die Tabelle, dass 319.936 Kinder in der Studie keine Geschwister hatten, von denen 4,2 % „ungeimpft“ waren, und 331.994 Geschwister ohne Autismus hatten, von denen 5,3 % „ungeimpft“ waren. Diese Anteile stehen im Gegensatz zu den 9,4 % der Kinder mit autistischen Geschwistern, die „ungeimpft“ waren. Kinder, die als „genetisch anfällig“ gelten, blieben somit 1,8-mal häufiger als Kinder mit nicht-autistischen Geschwistern und 2,3-mal häufiger als Einzelkinder MMR-ungeimpft. Betrachtet man erneut die Umweltrisikofaktoren für Autismus, zeigt Tabelle 1 der Studie, dass 3,97 % der Kinder mit „sehr geringem Risiko“, 4,35 % der Kinder mit „geringem Risiko“, 5,44 % der Kinder mit „mittlerem Risiko“ und 6,79 % der Kinder mit „hohem Risiko“ „ungeimpft“ blieben. Somit blieben Kinder mit „hohem Risiko“ 1,25-mal häufiger MMR-ungeimpft als Kinder mit „mittlerem Risiko“, 1,56-mal häufiger als Kinder mit „geringem Risiko“ und 1,71-mal häufiger als Kinder mit „sehr geringem Risiko“. Dies würde erneut auf eine mögliche Vermischung der „gesunden Benutzervoreingenommenheit“ mit Umwelt- und genetischen Risikofaktoren hinweisen.
Hviid et al. beschreiben ihre Studie als „bislang mit Abstand die größte Einzelstudie“ und geben an, dass sie „es uns erlaubt, aus einer Studie zu schlussfolgern, dass selbst geringfügige Erhöhungen des Autismusrisikos nach der MMR-Impfung unwahrscheinlich sind, vorausgesetzt, die Ergebnisse sind unvoreingenommen“. Wenn ihre Ergebnisse stattdessen dieselbe „gesunde Benutzervoreingenommenheit“ widerspiegeln, die Jain et al. festgestellt haben, dann lässt die Studie von Hviid et al. uns nicht zu, eine solche Schlussfolgerung zu ziehen. Bemerkenswerterweise erkennen Hviid et al. diese Einschränkung an: „Wenn das Auftreten von Symptomen dazu führt, dass die Impfung vermieden wird“, räumten sie ein, ist eine Voreingenommenheit zugunsten eines fehlenden Zusammenhangs „möglich“. Hätten sie „wahrscheinlich“ sagen sollen?
5.3. Versäumnis, alle in Dänemark routinemäßig empfohlenen Impfstoffe zu berücksichtigen
Die Studie von Hviid et al. konzentrierte sich nur auf die Wirkung des MMR-Impfstoffs auf die Autismusrate und nicht auf den vollständigen dänischen Impfplan für Kinder. In einer Sekundäranalyse berücksichtigten sie auch andere routinemäßig verabreichte Impfstoffe als Kovariablen. Aus dieser Sekundäranalyse kamen sie zu dem Schluss, dass „die MMR-Impfung das Autismusrisiko bei Kindern, die durch andere Impfungen in der frühen Kindheit gekennzeichnet waren, nicht erhöhte …“ Diese Analyse beschränkte sich jedoch auf „andere Impfungen im Kindesalter, die im ersten Lebensjahr verabreicht wurden“, und berücksichtigte nicht die Impfungen, die Kindern nach zwölf Monaten verabreicht wurden, mit Ausnahme der ersten MMR-Dosis, die normalerweise im Alter von 15 Monaten verabreicht wird. Andere von Hviid et al. berücksichtigte Impfstoffe umfassten fünf der sechs Impfstoffe, die von den dänischen Gesundheitsbehörden zur Routineanwendung bei Säuglingen unter einem Jahr empfohlen werden [101,102]. Hviid et al. beschrieben die „Hauptstützen“ des frühen dänischen Impfplans als „MMR und eine Kombination aus Diphtherie, Tetanus, azellulärem Keuchhusten, inaktivierter Polio und Haemophilus influenzae Typ b (DTaP-IPV/Hib)“. In Dänemark wurde die Kombination der DTaP-, IPV- und Hib-Impfstoffe für Säuglinge empfohlen, jeweils mit drei Dosen. Hviid et al. berücksichtigten jedoch nicht, dass die dänischen Behörden seit Oktober 2007 zusätzlich drei Dosen des Pneumokokken-Konjugatimpfstoffs (PCV) während des ersten Lebensjahres empfohlen hatten [103]. Die eingeführte Formulierung war der 7-valente PCV7, der ab April 2010 durch den 13-valenten PCV13 ersetzt wurde [104]. Eine zusätzliche vierte „Auffrischungsdosis“ des DTaP-IPV-Kombinationsimpfstoffs wird im Alter von 5 Jahren empfohlen [105]. Im Jahr 2005 wurde eine vierfache Hepatitis-B-Impfung (HepB) für Kinder empfohlen, deren Mütter bei der Geburt und im Alter von 1, 2 und 3 Monaten Trägerin des Virus sind [106]. Hviid et al. haben dies nicht berücksichtigt. Die Autoren haben auch den Impfstoff gegen humane Papillomaviren (HPV) nicht berücksichtigt [107,108]. Laut der Weltgesundheitsorganisation (WHO) [109] „ist die primäre Zielgruppe in den meisten Ländern, die eine HPV-Impfung empfehlen, junge heranwachsende Mädchen im Alter von 9 bis 14 Jahren.“ In Dänemark wurde der quadrivalente HPV-Impfstoff Gardasil von Merck [110] im Oktober 2008 als Aufholprogramm für 12-jährige Mädchen eingeführt, wobei die Routineimpfung für 12-jährige Mädchen im Januar 2009 begann. Der Nachbeobachtungszeitraum der Studie erstreckte sich vom 1. Januar 2000 bis zum 31. August 2013, und die Mädchen dieser ersten Geburtskohorte hätten das Alter von dreizehn oder vierzehn Jahren erreicht. Während Mädchen der nachfolgenden Kohorten zu jung für die HPV-Impfung gewesen wären (es sei denn, sie wurde vor dem 12. Lebensjahr verabreicht), könnten Mädchen dieser Kohorte von 1999 bis 2001 die HPV-Impfung ab 2011 erhalten haben.
Obwohl dies kein Fehler der Studie an sich ist, geht die Entscheidung von Hviid et al., ihren Fokus einzuschränken, nicht sinnvoll auf die Bedenken der Eltern hinsichtlich der langfristigen Auswirkungen des vollständigen und erweiterten dänischen Impfplans auf die Gesundheit ein [111]. Selbst wenn sie eine solche Studie durchgeführt hätten, wären die Ergebnisse jedoch nicht auf die US-amerikanische Kinderbevölkerung übertragbar gewesen, da in Dänemark ein anderer Impfplan gilt als in den USA empfohlen.
5.4. Änderung der MMR-Formulierung nicht berücksichtigt
Laut Hviid et al. enthielt der von 2000 bis 2007 in Dänemark verwendete MMR-Impfstoff den Masernvirusstamm Schwarz, was dem Impfstoff „Priorix“ von GlaxoSmithKline (GSK) entsprochen hätte. Von 2008 bis 2013 wurde eine andere Formulierung verwendet, die den Edmonton-Stamm von Enders enthielt, was „MMR-II“ von Merck entsprochen hätte. Dies würde darauf hindeuten, dass Kinder, die die Formulierung von Merck verwendeten, viel zu jung waren, um eine Autismusdiagnose zu erhalten, da sie zum Zeitpunkt der Studie höchstens 6 Jahre oder jünger waren. Bei näherer Betrachtung sind die von Hviid et al. bereitgestellten Informationen jedoch falsch; sie haben fälschlicherweise die Reihenfolge vertauscht, in der die MMR-Impfstoffe in diesen Zeiträumen verwendet wurden. Laut einer Studie von Sørup et al. aus dem Jahr 2018 über die Verwendung des MMR-Impfstoffs in Dänemark [112] wurde im dänischen Impfprogramm bis 2008 MMR-II von Merck verwendet, das in Europa unter dem Namen „Virivac“ vermarktet wurde und den Enders-Edmonston-B-Stamm des Masernvirus enthielt [113–115]. Ab Mitte Oktober 2008 wurde „Virivac“ durch „Priorix“ von GSK ersetzt, das den Schwarz-Stamm des Masernvirus enthielt [116]. Seit Mitte Juni 2013 wird eine neue Version von MMR-II von Merck verwendet, die von Sanofi Pasteur hergestellt und unter dem Namen „MMRvaxPro“ vermarktet wird und ebenfalls den Edmonston-Stamm des Masernvirus enthält [117–120]. Co-Autorin Christine Stabell Benn (persönliche Mitteilung, 19. August 2024) 121 korrespondierte mit der Hauptautorin Signe Sørup, um zu bestätigen, dass die Informationen in ihrem Artikel korrekt waren. Von 2008 bis 2013 wurde Priorix von GSK verwendet, nicht MMR-II von Merck, wie fälschlicherweise von Hviid et al. [122] berichtet (E-Mail-Korrespondenz ist im ergänzenden Material, Anhang 1, enthalten). Anschließend betrug das durchschnittliche Alter bei der Autismusdiagnose für ihre Studienpopulation 7,22 Jahre, und das typische Alter bei der ersten MMR-Impfung in Dänemark beträgt 15 Monate. Da der Nachbeobachtungszeitraum der Studie am 31. August 2013 endete, wären Kinder, die „Priorix“ erhielten, unter 5 Jahre alt und damit im Durchschnitt zu jung für eine Autismusdiagnose gewesen [123]. Dies könnte wiederum zu einer Verzerrung der Studie führen, da kein Zusammenhang zwischen dem Impfstoff, der dem Geburtsjahrgang 2008 – 2010 verabreicht wurde, und dem Autismusrisiko festgestellt wurde.
5.5. Kinder zu jung für Autismusdiagnose
Hviid et al. geben das Durchschnittsalter der Stichprobe mit 8,64 Jahren bei einer Standardabweichung (SD) von 3,48 Jahren an. Das Durchschnittsalter bei der Autismusdiagnose wird mit 7,22 Jahren angegeben, bei einer SD von 2,86 Jahren. Wenn das Diagnosealter einer Normalverteilung folgt, wären 34,2 % der Stichprobe (z = -0,408) zu jung für eine Autismusdiagnose. Dies könnte bis zu 3.387 zusätzliche Fälle erklären, die nicht in die Analyse einbezogen wurden, was die Ergebnisse weiter verzerren und die Akzeptanz der Nullhypothese und keinen Zusammenhang zwischen MMR-Impfstoff und Autismus begünstigen würde.
5.6. Versäumnis, eine Änderung des empfohlenen Alters für die 2. MMR-Dosis zu berücksichtigen
Hviid et al. berücksichtigten die zweite Dosis des MMR-Impfstoffs in ihrer primären Analyse nicht. In einer sekundären Analyse berichteten sie von „keinem Hinweis auf eine Dosis-Wirkungs-Beziehung“. Sie berücksichtigten jedoch keine Änderung des empfohlenen Alters, in dem die zweite Dosis verabreicht wird. In Dänemark wird für Kinder die erste Dosis des MMR-Impfstoffs im Alter von 15 Monaten empfohlen, gefolgt von einer zweiten Dosis im Alter von 4 Jahren. Vor April 2008 wurde die zweite Dosis jedoch routinemäßig im Alter von 12 Jahren verabreicht [124]. Deshalb hätten Kinder der Geburtsjahrgänge 1999 – 2001 und 2002 – 2004 die zweite Dosis erst Jahre nach dem durchschnittlichen Alter (7,22 Jahre) bei einer Autismusdiagnose für die gesamte untersuchte Population erhalten. Die zweite Dosis des MMR-Impfstoffs früher in der Kindheitsentwicklung statt in der frühen Adoleszenz kann mit einem erhöhten Autismusrisiko verbunden sein. Der Einschluss der Kohorten älterer Kinder, die während der frühen Kindheit nicht beide Dosen erhalten hatten, in die Sekundäranalyse würde die Ergebnisse erneut fälschlicherweise zugunsten der Akzeptanz der Nullhypothese verzerren.
5.7. Versäumnis, die Impfung der Mutter zu berücksichtigen
Die Impfung der Mutter ist ein weiterer Faktor, den Hviid et al. in ihrer Studie nicht berücksichtigt haben. In der wissenschaftlichen Gemeinschaft ist anerkannt, dass mütterliche Entzündungen mit der Entwicklung von Autismus bei den Nachkommen in Zusammenhang stehen [125]. Impfstoffe, die eine Immunreaktion mit Entzündungsmechanismen hervorrufen sollen, könnten die Plazenta infiltrieren, die fetale Entwicklung beeinträchtigen und das ASD-Risiko bei den Nachkommen erhöhen [126–128]. In Übereinstimmung mit den Empfehlungen der WHO [129] empfiehlt die dänische Gesundheitsbehörde seit 2010 schwangeren Frauen mit ausgewählten chronischen Hochrisikoerkrankungen in jedem Trimester eine saisonale Impfung gegen trivalente inaktivierte Spaltviren des Influenzavirus; und allen schwangeren Frauen wird die Impfung zusätzlich im zweiten und dritten Trimester empfohlen [130]. Mølgaard-Nielsen et al. berichten von einer Impfquote von bis zu 10 % bei dänischen Frauen zwischen 2010 und 2016. Das bedeutet, dass Kinder, die in der letzten Kohorte geboren wurden und am Ende des Beobachtungszeitraums 3 Jahre alt wurden, möglicherweise von Müttern geboren wurden, die während der Schwangerschaft geimpft wurden. Zukünftige Studien sollten pränatale Risikofaktoren berücksichtigen, darunter Impfungen und die Einnahme anderer Arzneimittel während der Schwangerschaft.
5.8. Ausschluss von Einwanderern
Hviid et al. schlossen nur Kinder ein, die „zwischen dem 1. Januar 1999 und dem 31. Dezember 2010 von in Dänemark geborenen Müttern geboren“ und im dänischen Geburtenregister registriert waren, und schlossen 1.498 Kinder aus. Asylsuchende in Europa können aus kriegszerrütteten Ländern kommen, in denen das Gesundheitssystem zusammengebrochen ist. Es gibt Hinweise darauf, dass asylsuchende Kinder in ihren Heimatländern nur eine geringe Impfrate haben, während sie in ihren Gastländern häufig geimpft werden [131,132]. Daher erhalten Einwandererkinder möglicherweise mehrere Impfungen, Dosen und Auffrischungsimpfungen auf einmal oder in kürzeren Abständen, um die Impfungen nachzuholen, die sie in ihrem Heimatland möglicherweise verpasst haben. Dies könnte Einwandererkinder einem höheren Risiko von Impfschäden und Entwicklungsstörungen wie Autismus aussetzen. Darüber hinaus können Kinder nicht-dänischer Abstammung aufgrund eines oder mehrerer epigenetischer Merkmale einem höheren Autismusrisiko ausgesetzt sein. Ihr Ausschluss könnte die Ergebnisse der Studie weiter verzerren.
5.9. Mögliche Fehlklassifizierung von Studienteilnehmern
Wie die Autoren einräumen, „besteht eine Einschränkung unserer Studie darin, dass wir das Datum der Erstdiagnose von Autismus verwendet haben, das im Vergleich zum Alter bei Symptombeginn wahrscheinlich später liegt.“ Sie legen dann nahe, dass dies ihre Ergebnisse zugunsten eines Zusammenhangs zwischen MMR-Impfung und Autismus verzerren könnte, indem sie ein hypothetisches Beispiel anführen, in dem „Symptome vor der Impfung auftreten und die Diagnose nach der Impfung erfolgt“, was zu einer „Fehlklassifizierung von Autismusfällen als geimpft“ führt. Während sie sich auf das hypothetische Szenario einer Voreingenommenheit zugunsten eines Zusammenhangs konzentrieren, berücksichtigen sie nicht die Fehlklassifizierung „geimpfter“ Kinder als „ungeimpft“. Eine 2017 von Holt et al. [133] veröffentlichte Studie, die Daten aus dem dänischen nationalen Gesundheitsregister verwendete, ging auf bekannte Bedenken hinsichtlich der Zuverlässigkeit der Daten zur Impfabdeckung ein. Zu diesem Zweck verglichen die Autoren der Studie die MMR-Impfabdeckung gemäß den Krankenakten von Allgemeinärzten mit denen der nationalen Registrierungsdatenbank. Die Forscher berichten, dass die nationale Datenbank eine deutlich niedrigere Impfabdeckung zeigte als die Krankenakten. Bei den in der Studie untersuchten Praxen wies die nationale Datenbank eine Impfabdeckung von 86 % aus, während die Krankenakten eine Abdeckung von 94 % zeigten. Die Studienautoren geben an: „Mehr als die Hälfte der Kinder, die laut den registerbasierten Daten nicht geimpft waren (55 %), waren laut den Krankenakten geimpft.“ Geimpfte Kinder in der Studie von Hviid et al. fälschlicherweise als „ungeimpft“ eingestuft zu haben, würde ihre Ergebnisse natürlich zugunsten der Nullhypothese und ohne Assoziation verzerren.
1. Diskrepanzen in der Autismusrate in der untersuchten Gruppe im Vergleich zur dänischen Bevölkerung
In Abbildung 1 ihrer Studie berichten Hviid et al. von 6.517 Kindern mit Autismus in einer Bevölkerung von 650.943, was 1 % entspricht. Dies umfasst nur Personen, die bis zum Ende der Studie beobachtet wurden. Berücksichtigt man die anfangs eingeschlossenen 657.461 Kinder, kann eine Autismusprävalenz von 0,99 % berechnet werden. Die Prävalenz von Autismus in Dänemark betrug im Jahr 2016 laut einer von Schendel und Thorsteinsson [134] veröffentlichten Studie 1,65 %. Bei einer Studienpopulation von 657.461 Kindern, von denen 650.943 bis zum Ende des Beobachtungszeitraums beobachtet wurden, und einer Prävalenzrate von 1,65 % müssten wir davon ausgehen, dass es zwischen 10.741 und 10.848 Kinder mit Autismus gibt, während es in der Studienpopulation nur 6.517 waren. Dies würde auf eine Untererfassung zwischen 4.224 und 4.331 hindeuten. Obwohl die Studie von Hviid et al. im Jahr 2019 veröffentlicht wurde, endete der Beobachtungszeitraum für die Studienpopulation am 31. August 2013. Daher wäre die Autismusprävalenz für dieses Jahr der aussagekräftigste Vergleich. Laut der Studie von Schendel und Thorsteinsson bei Kindern im Alter von 10 Jahren betrug die Prävalenz von Autismus im Jahr 2010 1,16 % (entspricht dem Geburtsjahrgang 2000 – 2001), 1,33 % im Jahr 2012 (Geburtsjahrgang 2002 – 2003), 1,44 % im Jahr 2014 (Geburtsjahrgang 2004 – 2005) und 1,65 % im Jahr 2016 (Geburtsjahrgang 2006 – 2007). Angesichts einer geschätzten Prävalenz von 1,33 % im Jahr 2012 würden wir erwarten, dass die Studienpopulation von Hviid et al. 8.658 bis 8.744 Kinder mit Autismus umfasst, was bedeutet, dass etwa 2.141 bis 2.227 autistische Kinder in der Studie fehlten. Dies deutet entweder darauf hin, dass Schendels und Thorsteinssons geschätzte Prävalenz von Autismus erheblich ungenau war oder dass die von Hviid et al. untersuchte Population nicht repräsentativ für die Kinderbevölkerung Dänemarks war. Die letzte Erklärung ist wahrscheinlicher, da die Studie von Schendel und Thorsteinsson im Gegensatz zu Hviid et al. zur Schätzung der Prävalenz konzipiert war und ihre Ergebnisse mit den Daten der CDC zur US-amerikanischen Kinderbevölkerung übereinstimmten, wobei für jeden Geburtsjahrgang ein Anstieg der Prävalenz von Autismus beobachtet wurde [135]. Im Gegensatz dazu zeigen die von Hviid et al. präsentierten Daten eine abnehmende Prävalenz von Autismus, wenn sie nach Alter der einzelnen Geburtsjahrgänge aufgeschlüsselt werden. Abbildung 3 von Hviid et al. fasst die Gesamtzahl der Kinder mit Autismus für jeden Geburtsjahrgang zusammen. Dadurch kann die Prävalenz der Diagnose basierend auf dem Alter für jeden Geburtsjahrgang berechnet werden; nämlich 1,71 % für die Kohorte 1999 – 2001, 1,28 % für 2002 – 2004, 0,74 % für 2005 – 2007 und 0,20 % für 2008 – 2010. Diese Diskrepanzen würden auf methodische Mängel in der Studie von Hviid et al. hinweisen, die ihre Studienpopulation nicht repräsentativ machen. Die Autoren erkennen diese Diskrepanzen nicht an, geschweige denn liefern sie eine Erklärung.
2. Nicht reproduzierbare Ergebnisse
Reproduzierbarkeit ist ein wesentlicher Aspekt der wissenschaftlichen Methode [136]. Sie ist entscheidend für die Weiterentwicklung wissenschaftlicher Erkenntnisse, da sie sicherstellt, dass Forschungsergebnisse zuverlässig sind und nicht auf Fehlern, Zufall oder Voreingenommenheit beruhen. Ohne Reproduzierbarkeit bleiben wissenschaftliche Behauptungen unbestätigt und ihre Zuverlässigkeit ist daher fraglich. Während die von Hviid et al. vorgelegten Daten eine abnehmende Autismusrate von einer Geburtskohorte zur nächsten zeigen, geben sie in ihrem Artikel widersprüchlich an, dass die Zugehörigkeit zur später geborenen Kohorte 2008 – 2010 das „höchste Autismusrisiko“ mit sich bringt. Bei Betrachtung von Tabelle 3 in der SI von Hviid et al. wird jedoch deutlich, dass dies nicht der Fall ist. al., die die Kohorte 1999 – 2001 als Referenz verwenden, berichten von einem HR von 1,18 für 2002 – 2004, 1,31 für 2005 – 2007 und 1,34 für 2008 – 2010. Kinder, die 2009 – 2010 geboren wurden, hatten also eine 1,34-mal höhere Wahrscheinlichkeit, mit Autismus diagnostiziert zu werden, als Kinder, die 1999 – 2001 geboren wurden, und so weiter. Obwohl dieses steigende Risiko, wie gezeigt, zu erwarten ist, widerspricht es direkt den in ihrem Artikel gezeigten Daten. Diese rätselhafte Diskrepanz wurde der Statistikerin Elizabeth Clarkson (persönliche Mitteilung, 4. April 2019) aufgefallen. Sie kontaktierte die Mitarbeiter der Annals of Internal Medicine und den Hauptautor der Studie, Anders Hviid, um sich nach diesem Widerspruch zu erkundigen und ihre Rohdaten anzufordern (der E-Mail-Verkehr findet sich im ergänzenden Material, Anhang 2) [137]. In seiner Antwort auf Clarksons E-Mail-Anfrage bestätigte Hviid, dass der von der Personalabteilung aufgezeigte Trend anhand der im Hauptartikel präsentierten Daten nicht reproduziert werden könne. Er sagte jedoch, sie könnten ihre Rohdaten nicht veröffentlichen, da es ihnen „nach dänischem Recht verboten sei, diese Daten weiterzugeben“. Clarkson schrieb daraufhin an die Herausgeber der Annals, um den Datensatz der Autoren offiziell anzufordern, und wies darauf hin, dass „die Ergebnisse dieses ausgeklügelten Regressionsmodells, das für die in Tabelle 3 des ergänzenden Materials berichteten Ergebnisse verwendet wurde, im direkten Widerspruch zu den groben Assoziationen stehen, die aus den im Artikel selbst veröffentlichten Daten berechnet wurden.“ In ihrer Antwort an Elizabeth Clarkson wies die Redaktion der Zeitschrift sie an, ihre Anfrage direkt an die Autoren der Studie zu richten. Da es einen erheblichen Widerspruch zwischen den berichteten Daten und ihren berechneten HRs gibt, müssen ernsthafte Bedenken hinsichtlich ihrer tatsächlichen wissenschaftlichen Durchführbarkeit und Nichtreproduzierbarkeit geäußert werden.
3. Unerklärliches Autismusrisiko für Jungen und Mädchen mit genetischer Anfälligkeit
In der Zusammenfassung fügte Hviid den Vorbehalt ein, dass „in Untergruppen von Kindern, die nach der Autismusvorgeschichte ihrer Geschwister definiert wurden, kein durchgängig erhöhtes Autismusrisiko nach der MMR-Impfung beobachtet wurde“. Eine Interpretation des Adverbs „durchgängig“ würde logischerweise implizieren, dass bei mindestens einer dieser Untergruppen von Kindern ein erhöhtes Risiko beobachtet wurde. Tatsächlich zeigt Abbildung 4 in der SI von Hviid et al. für Jungen mit einem autistischen Geschwisterkind die kumulative Inzidenz. Sie stellt die männlichen Kinder dar, die das Kriterium des Autors für eine „genetische Anfälligkeit“ für Autismus erfüllten. Ab einem Alter von etwa 7 Jahren war die kumulative Autismusinzidenz höher bei den Kindern, die den MMR-Impfstoff erhalten hatten. Dieses erhöhte Autismusrisiko unter den geimpften Jungen war statistisch nicht signifikant, was ein Artefakt einer kleinen Untergruppe von Jungen sein könnte, die in dieser Analyse berücksichtigt wurden.
Dieselbe Abbildung zeigt die kumulative Autismus-Inzidenz bei Mädchen mit einem autistischen Geschwisterkind. Im Alter von etwa 4 bis 11 Jahren ist bei Mädchen mit „genetischer Anfälligkeit“ eine höhere kumulative Inzidenz für diejenigen zu sehen, die den MMR-Impfstoff erhalten haben. Im Alter zwischen 11 und 12 Jahren steigt die kumulative Inzidenz bei MMR-ungeimpften Mädchen jedoch sprunghaft von etwa 1 % auf etwa 9 %, was zu einer höheren Autismus-Inzidenz bei den Ungeimpften führt. Da der Beobachtungszeitraum der Studie 2013 endete, kann das maximale Alter von 14 Jahren in dieser Grafik nur Mädchen darstellen, die 1999 geboren wurden. Zum Vergleich: Nur Kinder, die 2002 oder früher geboren wurden, konnten vor Ende der Studie das Alter von 11 Jahren erreicht haben. Über die Ursache des plötzlichen Anstiegs der kumulativen Autismushäufigkeit im Alter von etwa 11 Jahren, der für die Geburtsjahrgänge 1999 – 2001 und 2002 – 2004 relevant wäre, kann nur spekuliert werden. Die Autoren diskutieren diesen plötzlichen Anstieg der kumulativen Häufigkeit nicht, was sicherlich eine Kuriosität ist, für die eine Erklärung gerechtfertigt wäre, aber fehlt.
4. Keine Generalisierbarkeit auf die US-Kinderbevölkerung
Unter Berücksichtigung der Unterstützung von Hviid et al. durch die US-amerikanischen Medien, Regulierungsbehörden und medizinischen Fachorganisationen und ihrer Behauptungen, die Impf-Autismus-Hypothese sei widerlegt, erhebt sich die Frage, ob die hier präsentierten Schlussfolgerungen auf die US-Bevölkerung verallgemeinert werden können. Während die dänischen Gesundheitsbehörden den HepB-Impfstoff für (als) gefährdete Säuglinge empfehlen, empfiehlt das CDC eine Impfkur mit drei Dosen dieses aluminiumhaltigen Impfstoffs für alle Säuglinge ab dem ersten Tag der Geburt. Ähnlich wie in Dänemark erhalten Kinder in den USA während ihres ersten Lebensjahres normalerweise jeweils drei Dosen DTaP-, IPV-, Hib- und Pneumokokken-Konjugatimpfstoff (PCV15 oder PCV20); aber ab einem Alter von 6 Monaten erhalten amerikanische Kinder auch zwei oder drei Dosen Rotavirusimpfstoff (RV1 bzw. RV5) und einen inaktivierten Grippeimpfstoff (IIV), dessen Mehrfachdosisformulierungen das Konservierungsmittel Thiomersal enthalten [138]. Der Rotavirusimpfstoff wird in Dänemark nicht empfohlen, und während die dänischen Behörden Grippeimpfungen nur für Kinder im Alter von 2 bis 6 Jahren und Erwachsene ab 65 Jahren empfehlen, empfiehlt das CDC jährliche Grippeimpfungen, deren Mehrfachdosisformulierungen ebenfalls Thiomersal enthalten, beginnend im Säuglingsalter und während des gesamten Lebens des Patienten. Während dänische Kinder im Alter von 5 Jahren eine Auffrischungsdosis DTaP und IPV erhalten, erhalten amerikanische Kinder eine vierte Dosis IPV mit 4 Jahren und für DTaP eine vierte Dosis im Alter von 15 Monaten, eine fünfte Dosis im Alter von 4 Jahren und eine Auffrischungsdosis der Jugend- und Erwachsenenformulierung Tdap im Alter von 11 Jahren. Während in Dänemark die erste MMR-Dosis normalerweise im Alter von 15 Monaten verabreicht wird, wird sie in den USA früher, nämlich mit 12 Monaten, empfohlen. Eine zweite Dosis wird in beiden Ländern im Alter von 4 Jahren verabreicht. Die Varizellen-Impfung (VAR) oder „Windpocken“-Impfung steht in Dänemark nicht auf dem Impfplan für Kinder, wird aber vom CDC im Alter von 1 Jahr und eine zweite Dosis im Alter von 4 Jahren empfohlen. Die Hepatitis-A-Impfung (HepA) steht in Dänemark ebenfalls nicht auf dem Impfplan, das CDC empfiehlt jedoch eine Serie von zwei Dosen im Abstand von sechs Monaten ab einem Alter von 1 Jahr. Auch der Meningokokken-Impfstoff (Men) wird in Dänemark nicht routinemäßig empfohlen. Das CDC empfiehlt ihn jedoch ab dem Alter von 11 Jahren mit einer zweiten Dosis im Alter von 16 Jahren. Während der HPV-Impfstoff in Dänemark für Kinder ab 12 Jahren empfohlen wird, empfiehlt das CDC das Zwei-Dosen-Schema ab dem Alter von 11 Jahren und genehmigt die Verabreichung bereits für Kinder ab 9 Jahren. Darüber hinaus empfiehlt das CDC den aluminiumhaltigen Tdap-Impfstoff, den potenziell thiomersalhaltigen Grippeimpfstoff und den Impfstoff gegen das respiratorische Synzytialvirus (RSV) für schwangere Frauen [139].
Zusammenfassend empfiehlt das CDC 73 Impfungen gegen 17 Krankheiten, davon sage und schreibe 28 Injektionen bis zum ersten Geburtstag eines Neugeborenen. Bei einem zweimonatigen „Vorsorgetermin“ kann ein Säugling bis zu sechs Impfungen gegen acht Krankheitserreger erhalten. Zum Vergleich: Der dänische Impfplan sieht zwölf Impfungen gegen sechs Krankheitserreger vor, davon nur vier Impfungen bis zum ersten Geburtstag (je drei Dosen DTaP, IPV, Hib und PCV13). Auch in den USA sind sich viele Meinungsführer, Regulierungsbehörden, Medien und Berufsverbände dieser auffälligen Unterschiede nicht bewusst.
5. Interessenkonflikte
In der ASD-Debatte steht viel auf dem Spiel. Im Laufe eines halben Jahrhunderts ist die Zahl der ASD-Fälle dramatisch gestiegen [140]. Die Identifizierung der Ursachen von ASD ist für die wissenschaftliche Gemeinschaft bereits eine anspruchsvolle Aufgabe, die höchste Standards an Offenheit und Transparenz erfordert. Jede Abweichung von diesen Standards wäre ein Bärendienst für alle. Auch finanziell steht in der Impfstoffforschung viel auf dem Spiel. Der globale Markt für Biologika betrug im Jahr 2024 511,04 Milliarden US-Dollar und soll bis 2033 rund 1.374,51 Milliarden US-Dollar erreichen [141]. Die Zulassung und anschließende Kommerzialisierung von Gentherapiekandidaten dürfte das Wachstum auf dem Biologikamarkt vorantreiben. Der weltweite Impfstoffmarkt wurde im Jahr 2023 auf 81,06 Milliarden US-Dollar geschätzt und soll bis 2033 rund 152,45 Milliarden US-Dollar erreichen [142]. In den USA ging der COVID-19-Impfstoffmarkt in eine kommerzielle Phase über, nachdem die von der Bundesregierung gekauften Vorräte erschöpft waren. Der globale Markt für Mumps-Impfstoffe wurde 2021 auf 2 Milliarden US-Dollar geschätzt und soll 2031 3,5 Milliarden US-Dollar erreichen [143]. Wenn Interessenkonflikte die Forschung beeinflussen, kann die daraus resultierende wissenschaftliche Debatte über Sicherheit und Effizienz usw. durch irreführende Informationen verfälscht werden. Um die wissenschaftliche Qualität sicherzustellen, müssen Manuskripte, die von CDC-Mitarbeitern verfasst wurden, tatsächlich einem internen Überprüfungs- und Genehmigungsprozess unterzogen werden, der als Clearance bezeichnet wird. Im Rahmen der ethischen Standards wird ausdrücklich „frei von Interessenkonflikten“ angegeben [144]. Kern et al. [145] fassen frühere und aktuelle Beispiele für Forschungsinteressenkonflikte und äußere Einflüsse für Tabak, Blei, Methylquecksilber, Atrazin, Bisphenol A und Olestra zusammen. Die CDC erhält Millionen von Dollar an Zuwendungen und Fördermitteln von der Industrie, darunter erhebliche Unterstützung von der Pharmaindustrie [146,147]. Miller und Goldman [148] sowie Hooker [149,150] liefern aus erster Hand Einzelheiten darüber, wie die CDC die Veröffentlichung schädlicher Impfdaten unterdrückte oder untersagte und sich an weiteren Handlungen von fragwürdiger wissenschaftlicher Integrität beteiligte. Nissen [151] erörtert die Abhängigkeit professioneller medizinischer Verbände von der Finanzierung durch die Industrie [152].
Ärzte und Öffentlichkeit verlassen sich auf Fachzeitschriften als unvoreingenommene und unabhängige Informationsquellen und darauf, dass sie eine führende Rolle bei der Verbesserung des Vertrauens in die Medizin und die medizinische Literatur spielen. Finanzielle Interessenkonflikte haben jedoch wiederholt die Glaubwürdigkeit der Ärzteschaft und der Fachzeitschriften untergraben [153]. Im letzten Jahrzehnt haben sich zwei ehemalige Chefredakteure des NEJM, Marcia Angell und Arnold Relman, über die übermäßige Macht der Pharmaindustrie über die medizinische Forschung, Krankenhäuser und Ärzte geäußert. In einem Brief an die New York Times vom 28. Dezember 2004 [154] wiesen sie darauf hin, dass ein Pharmaunternehmen im vergangenen Jahr 28 Prozent seines Umsatzes (mehr als 6 Milliarden Dollar) für Marketing- und Verwaltungskosten ausgegeben hatte. Sie kamen zu dem Schluss: „Die Ärzteschaft sollte ihre Abhängigkeit von der Pharmaindustrie beenden und ihre eigene Branche aufklären.“ In einem Artikel in der New York Review of Books vom 15. Januar 2009 schrieb Angell: „Es ist einfach nicht mehr möglich, einen Großteil der veröffentlichten klinischen Forschungsergebnisse zu glauben oder sich auf das Urteil vertrauenswürdiger Ärzte oder maßgeblicher medizinischer Richtlinien zu verlassen“ [155].
5.10. Hviid et al.
Hviid und seine drei Koautoren (Hansen, Frisch und Melbye) waren zum Zeitpunkt der Veröffentlichung der Studie mit dem Statens Serum Institut (SSI) verbunden, das Impfstoffe entwickelt und „für den Kauf und die Versorgung der dänischen nationalen Impfprogramme mit Impfstoffen verantwortlich ist“ [156]. Wie das CDC ist das SSI eine Regierungsbehörde und ein Forschungsinstitut; sein Zweck ist es, „Vorsorge gegen Infektionskrankheiten und biologische Bedrohungen sowie die Kontrolle angeborener Krankheiten sicherzustellen“. In der Impfstoffforschung widmet sich das SSI „Impfstoffen gegen Tuberkulose, Chlamydien, HIV und neuen Adjuvantien zur Lenkung und Verstärkung der Immunreaktionen“. Nach Veröffentlichung der Studie gab das SSI eine Pressemitteilung heraus, in der es erklärte, dass diese „einmal mehr die Behauptung widerlegt, dass der MMR-Impfstoff das Risiko von Kindern, Autismus zu entwickeln, erhöht“ [157].
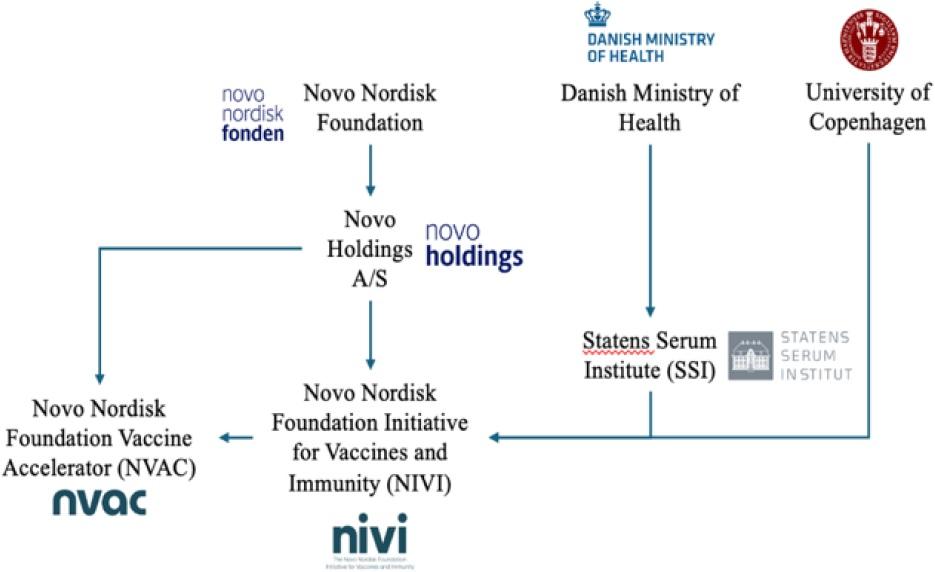
Finanzielle Unterstützung leisteten die Novo Nordisk Foundation [158,159] und das dänische Gesundheitsministerium [160]. Die Novo Nordisk Foundation ist eine wohltätige Stiftung, die Fördermittel für die wissenschaftliche Forschung vergibt und zugleich Eigentümerin der Holding Novo Holdings A/S [161] ist, des Mehrheitsaktionärs des dänischen Pharmakonzerns Novo Nordisk [162]. Novo Nordisk ist ein großes multinationales Pharmaunternehmen in Dänemark mit einer Marktkapitalisierung von über 497 Milliarden US-Dollar [163]. Laut ihrem Jahresbericht erwartet sie für 2019 einen effektiven Steuersatz von 20-22 %. Der dänische Staat erhält erhebliche Steuereinnahmen von Novo Nordisk. Deshalb haben das dänische Gesundheitsministerium und Novo Nordisk ein begründetes Interesse an einer Studie, die die Nachfrage nach dem MMR-Impfstoff beeinflussen könnte. Bemerkenswert ist auch, dass zu den Investitionen von Novo Holdings A/S auch Impfstoffunternehmen gehören [164]. So investierte die Gruppe im April 2019 beispielsweise mehrere zehn Millionen Dollar in Oxford Biomedica, das an einem Konsortium zur Entwicklung und Herstellung des AstraZeneca-COVID-19-Impfstoffs beteiligt war [165,166]. Im Dezember 2023 wurde die Novo Nordisk Foundation Initiative for Vaccines and Immunity (NIVI) angekündigt [167], eine Partnerschaft zwischen der Universität Kopenhagen und dem SSI [168,169]. Das erklärte Ziel von NIVI ist es, „die Impfstoffentwicklung in Dänemark zu revolutionieren und zu beschleunigen, indem die Lücke zwischen akademischer Forschung und Brancheninnovation geschlossen wird“. Gleichzeitig gründete die Stiftung eine Gesellschaft mit beschränkter Haftung, den Novo Nordisk Foundation Vaccine Accelerator (NVAC), um „die translationalen Bemühungen von NIVI zu unterstützen, indem wir branchenweites Fachwissen in der Impfstoffentwicklung bereitstellen und die frühen klinischen Tests unserer Impfstoffkandidaten durchführen“ [170]. Bereits vor ihrer Impfinitiative hatte die Novo Nordisk Foundation zahlreiche Forscher des SSI und anderer Institutionen finanziert, die in der Impfstoffforschung tätig sind [171–176]. Die Stiftung finanzierte auch die „Danish National Biobank“ des SSI, die Wissenschaftlern Zugang zu Daten über Einwohner Dänemarks aus nationalen Gesundheitsregistern sowie zu Informationen über biologische Proben gewähren soll [177]. Das dänische Gesundheitsministerium und das SSI haben zweifellos ein Interesse daran, ihre eigene Glaubwürdigkeit und ihre bestehenden Richtlinien zu wahren, ähnlich wie das US-Gesundheitsministerium (HHS) und die CDC. Wie in Abbildung 1 zusammengefasst und im Fall amerikanischer Aufsichtsbehörden und Berufsverbände dokumentiert [178], wird jedoch ein inhärenter Interessenkonflikt bei der Erforschung, Vermarktung und Bereitstellung von Kinderimpfstoffen offensichtlich, wenn nicht sogar explizit.
5.11. Annals of Internal Medicine
Zwei Herausgeber der Annals of Internal Medicine, Jaya K. Rao (stellvertretende Herausgeberin) und Catharine B. Stack (stellvertretende Herausgeberin für Statistik), gaben bekannt, dass sie Aktien von Pharmaunternehmen besitzen, die in der Impfstoffforschung und -herstellung tätig sind. Dazu gehören Eli Lilly, Pfizer und Johnson & Johnson. Eli Lilly ist ein ehemaliger Hersteller des inaktivierten Polioimpfstoffs von Dr. Jonas Salk und der Entwickler des quecksilberhaltigen Konservierungsmittels Thiomersal [179].
6. Diskussion
2019 begrüßten die AAP und die Mainstream-Medien in den USA die Studie von Hviid et al. als weiteren Beweis dafür, dass der MMR-Impfstoff das ASD-Risiko nicht erhöht, nicht einmal bei „genetisch anfälligen Kindern“. Tatsächlich haben die Autoren der Studie Kinder mit einer von mehreren genetischen Erkrankungen, die sie einem höheren Risiko aussetzen, ausgeschlossen, da sie den Begriff „genetische Anfälligkeit“ unzureichend definiert haben. Aufgrund der aufgezeigten methodischen Mängel, Unstimmigkeiten und Interessenkonflikte würden wir behaupten, dass die Ergebnisse von Hviid et al. keinen Hinweis auf einen fehlenden Zusammenhang zwischen ASD und MMR darstellen, sondern vielmehr auf eine Voreingenommenheit der Forscher, a priori dem Status quo zu dienen. Als Gegenmittel würden wir gewissenhaften Wissenschaftlern auf diesem Gebiet empfehlen, Hviid et al. zur Kenntnis zu nehmen und von ihnen zu lernen, indem sie a priori Auswahlverzerrungen und Risikofaktoren, „gesunde Benutzervoreingenommenheit“ und eine Datenkalibrierung mit positiven und negativen Kontrollen berücksichtigen [180], was den Weg zu der dringend benötigten Genauigkeit in Beobachtungsstudien ebnen würde; Dies gilt insbesondere, wenn so viel auf dem Spiel steht und die CDC-Ziele eine flächendeckende Impfung der pädiatrischen Bevölkerung anstreben.
Hviid und Kollegen verwendeten ähnliche Methoden, um das Risiko anderer Nebenwirkungen und Erkrankungen durch MMR-Impfungen und andere während der Schwangerschaft oder Kindheit eingenommene Arzneimittel zu beurteilen. So berichteten Hviid und Kollegen von keinem Zusammenhang zwischen ASS und thiomersalhaltigen Impfstoffen [181], von keinen Hinweisen auf einen kausalen Zusammenhang zwischen Impfungen im Kindesalter und Typ-1-Diabetes [182], von einer erhöhten Rate an Fieberkrämpfen nach MMR-Impfungen, die „selbst bei Hochrisikokindern gering“ sei [183], von keinem signifikanten Zusammenhang zwischen der Einnahme selektiver Serotonin-Wiederaufnahmehemmer durch die Mutter während der Schwangerschaft und ASS bei ihren Nachkommen [184] und von keinem Zusammenhang zwischen Ondanse (verschrieben gegen Übelkeit und Erbrechen) und einem erhöhten Risiko für fetale Nebenwirkungen [185]. Wir möchten darauf hinweisen, dass in Studien zu Fieberkrämpfen und Typ-I-Diabetes bei pädiatrischen Patienten die Bewertung der „genetischen Anfälligkeit“ wie bei Hviid et al. 2019, basierte auf der Familienanamnese, d. h. auf der Vorgeschichte von Nebenwirkungen bei Geschwistern oder der Diagnose von Diabetes. Klinische und präklinische Nachweise von Nebenwirkungen dieser Arzneimittel sind gut dokumentiert [186–189]. Eine weitere kritische Analyse dieser Studien, wie sie hier für Hviid et al. 2019 bereitgestellt wird, wäre sinnvoll, empfehlenswert und dringend erforderlich.
In einem berühmten Fall räumte die Regierung ein, dass die Verabreichung von neun Impfstoffdosen auf einmal an ein 19 Monate altes Mädchen namens Hannah Poling „eine zugrunde liegende mitochondriale Störung erheblich verschlimmerte, die sie anfällig für Defizite im zellulären Energiestoffwechsel machte und sich als regressive Enzephalopathie mit Merkmalen einer autistischen Störung manifestierte“ [190]. Damals gab die damalige CDC-Direktorin Julie Gerberding auf CNN [191] zu: „Jetzt wissen wir alle, dass Impfstoffe bei Kindern gelegentlich Fieber verursachen können. Wenn also ein Kind immunisiert wurde, Fieber bekam, andere Komplikationen durch die Impfstoffe auftraten und wenn es anfällig für eine mitochondriale Störung ist, kann dies sicherlich einige Schäden auslösen. Einige der Symptome können Symptome sein, die Merkmale von Autismus aufweisen.“ Bemerkenswerterweise gab Gerberding im Jahr 2009 ihren Regierungsjob auf, um für den Pharmagiganten Merck als Leiterin der Impfstoffabteilung zu arbeiten und wurde später als Chief Patent Officer und Executive Vice President des Unternehmens, Population Health & Sustainability, für die „strategische Kommunikation“ verantwortlich [192,193].
Tatsächlich deutet eine wachsende Zahl von Beweisen auf ein starkes Zusammenspiel zwischen Umweltschäden und Epigenetik in der Ätiologie und Pathogenese von ASD hin [194]. Bradstreet argumentierte in einer Präsentation vor dem Vaccine Safety Committee im Jahr 2004 [195], dass „aussagekräftige epidemiologische Studien a priori Hypothesen testen sollten, die sich aus allen Hinweisen ergeben, die in der Krankengeschichte betroffener Kinder erkennbar sind …“. Wir würden zukünftige prospektive Beobachtungsstudien unterstützen und unterstützen, die epigenetische und umweltbedingte Risikofaktoren als Teil des umfassenderen „ökologischen Exposoms“ wirklich berücksichtigen [196]. Obwohl dies keine triviale Aufgabe ist, bietet die SSI-Biobank-Initiative dänischen Forschern Zugang zu „25 Millionen biologischen Proben“ [197], die ausreichend sein sollten, um den Zusammenhang zwischen genetischer Anfälligkeit, MMR und ASD zu definieren und zu untersuchen. In einem Interview mit der Journalistin Sharyl Attkisson im Jahr 2014 räumte Frank DeStefano, Direktor des Immunization Safety Office des CDC, ein, dass „es möglich“ sei, dass Impfstoffe bei „genetisch anfälligen Personen“ Autismus auslösen könnten, dass es jedoch „schwer vorherzusagen sei, wer diese Kinder sein könnten“ und dass es „sehr schwierig“ sei, zu bestimmen, welche Grunderkrankungen Kinder einem höheren Risiko aussetzen, durch Impfstoffe geschädigt zu werden [198]. Tatsächlich haben Forscher am CDC eingeräumt, dass keine Beobachtungsstudie „die Hypothese, dass die Exposition gegenüber Thiomersal das Risiko von Autismus erhöht, definitiv belegen oder widerlegen kann“, was stattdessen „eine groß angelegte prospektive randomisierte Studie“ erfordern würde [199].
Es gibt keinen goldenen Standard, um zu beurteilen, ob eine beobachtete Assoziation (oder Nicht-Assoziation) echt ist [200]. Placebokontrollierte randomisierte klinische Studien (RCT) bleiben, obwohl sie ebenfalls fehleranfällig sind [201], der Goldstandard für die Schlussfolgerung von Kausalität. Allerdings hat keine placebokontrollierte RCT einzelne Impfstoffe untersucht, geschweige denn die Gesamtwirkung des Impfplans auf langfristige gesundheitliche Folgen bei geimpften und ungeimpften Kindern, einschließlich der Gesamtmortalität. Die FDA-Regulierungsbehörden sind sich allgemein einig, dass es unethisch ist, klinische Studien zum Thema „Impfen und Unimpfen“ mit echten Kochsalz-Placebos durchzuführen [202]. Wir stimmen dem insofern zu, als es nicht nur unethisch, sondern barbarisch wäre, im Laufe eines Jahres im Rahmen einer klinischen Studie 28 intramuskuläre Injektionen eines Kochsalz-Placebos oder mehrerer „biologischer Arzneimittel“ in die Haut eines Babys zu verabreichen, die alle unterschiedlich formuliert sind, viele davon in einer Sitzung. Darüber hinaus ist dies ein exemplarisches Beispiel für den Petitio-Principii-Irrtum und die institutionelle kognitive Dissonanz in der Impfstoffforschung, da a priori davon ausgegangen wird, dass der potenzielle Nutzen alle möglichen Risiken überwiegt, was genau die Annahme ist, die, wie auch Bradstreet argumentiert, durch richtig konzipierte, strenge und robuste RCTs hätte ermittelt werden müssen. Trotzdem wäre ein Wort der Vorsicht angebracht. Wir möchten feststellen, dass es kein „Allheilmittel“ zum Testen der Kausalität gibt, insbesondere bei seltenen und/oder langfristigen schwerwiegenden Nebenwirkungen. Tatsächlich können Fragen der Kausalität nicht allein durch RCTs beantwortet werden, da solche Studien von Natur aus eine geringe Aussagekraft haben [203]. Auch die Herstellung pharmazeutischer Biologika muss diskutiert werden. Während die chemische Synthese eines niedermolekularen Arzneimittels ein Dutzend Schritte umfassen kann, die überwacht und kontrolliert werden müssen, kann der Fermentationsprozess für Impfstoffe Hunderte umfassen [204]. Valiant et al. [205] und Chooi et al. [206] liefern zahlreiche Beispiele für frühere und aktuelle Berichte über Kontaminationsprobleme und Impfstoffrückrufe. Zweifellos handelt es sich dabei um einen wichtigen Risikofaktor für Impfschäden, wie dies bei jedem Arzneimittel der Fall ist, das zur ubiquitären Prophylaxe der pädiatrischen Bevölkerung bestimmt ist [207].
Die Herausforderungen bei der Ableitung von Schlussfolgerungen aus den Beweisen sind nicht weniger groß (aber nicht besonders größer), wenn die Beweise auf großen Beobachtungsstudien beruhen, wie bei Hviid et al. (oder auf einer kleinen klinischen Fallserie, wie bei Wakefield et al.). Wenn man jedoch wirklich einen evidenzbasierten Ansatz verfolgt, wäre es nicht ratsam, sich hinsichtlich der Impfungen selbstzufrieden zu fühlen und ihre Unschuld aufgrund von Beobachtungsstudien oder sogar systematischen Überprüfungen der Beweise anzunehmen [208]. Bereits 2004 wiesen Price, Jefferson und Demicheli auf methodologische Probleme hin, die sich aus systematischen Überprüfungen der Impfstoffsicherheit ergeben, insbesondere bei seltenen und/oder langfristigen schwerwiegenden Nebenwirkungen [209]. Darüber hinaus stellen immer mehr Wissenschaftler, Angehörige der Gesundheitsberufe und Bürger den Nutzen von Impfstoffen in Frage, da es Hinweise darauf gibt, dass die Kindersterblichkeit und die Erkrankungsrate durch Infektionskrankheiten bereits vor der weit verbreiteten Verwendung deutlich zurückgegangen waren [210–212]. Basierend auf ihren Beobachtungen kann man hoffen, dass Impfungen durch gute Hygiene, angemessene Abfallentsorgungssysteme, sauberes Wasser, nahrhafte Lebensmittelversorgung, Wohlstand und Überfluss für alle Kinder überflüssig werden [213]. Dennoch bleibt die Möglichkeit bestehen, dass wir durch Impfungen langfristige Schäden verursachen, was sich in der deutlichen Zunahme schwerer und chronischer Krankheiten, einschließlich Autoimmunerkrankungen, zeigt, insbesondere in Bevölkerungsgruppen, die durch akute oder chronische anthropogene xenobiotische Schädigungen anfällig sind [214,215].
Hviid et al. liefern ein Beispiel dafür, wie Studien, die diese Frage im Zusammenhang mit dem MMR-Impfstoff untersuchen, so interpretiert werden könnten, als seien sie so angelegt, dass sie keinen Zusammenhang finden, da Designfehler die Ergebnisse verzerren. Darüber hinaus wurden bis heute keine Studien durchgeführt, die die Hypothese testen sollten, dass Impfungen gemäß dem Zeitplan der CDC zur Entwicklung von Autismus, chronischen Krankheiten und Gesamtmortalität bei Kindern mit epidemiologischer Anfälligkeit beitragen können. Daher müssen Wissenschaftler und Mediziner immer auf der Hut vor Beweisen sein, die auf die Gefährlichkeit von Impfstoffen hinweisen, wie dies bei Nebenwirkungen jeder pharmazeutischen Intervention der Fall sein sollte [216]. Beweise allein sprechen nie für sich selbst oder vermitteln die Wahrheit, da sie immer interpretiert werden müssen. Expertenmeinungen oder bevölkerungsbasierte Studien sind kein Ersatz für beweisbasierte Erfahrungen oder Daten aus erster Hand; in der Wissenschaft geht es nicht um Konsens, sondern um die Wahrheit [217,218]. Darüber hinaus erfordert das Erhalten der richtigen Antworten auch das Stellen der richtigen Fragen. Barosi und Gale verdeutlichen dies, indem sie sagen: „Genauigkeit bedeutet, die richtige Antwort zu erhalten, und Präzision bedeutet, bei Wiederholung dieselbe Antwort zu erhalten, unabhängig davon, ob es die richtige Antwort ist oder nicht. Eine falsche Antwort, die reproduzierbar ist, ist zwar präzise, aber ungenau. Was wir brauchen, sind genaue, präzise Antworten.“ Basierend auf dem hier vorgestellten Fall könnte für Hviid et al. nichts für die Zukunft der Impfstoffforschung wichtiger sein.
7. Schlussbemerkungen
Die Wissenschaft der Impfstoffsicherheit ist zu einer gefährlichen Beschäftigung geworden [219]. Die Heiligkeit von Impfstoffen ist zu einem religiösen Mantra geworden, und jeder, der die Sicherheit oder Wirksamkeit von behördlich empfohlenen Impfstoffen in Frage stellt oder von der akzeptierten Impforthodoxie abweicht, ist Unterdrückung und persönlichen Angriffen ausgesetzt [220]. Die Folgen können schwerwiegend sein und Rufschädigung, Behinderung der Forschung und sogar die Zerstörung einer Karriere umfassen. Zu den Unterdrückungstaktiken, von denen die Forscher und Ärzte in der Studie von Elisha et al. [221] berichten, gehören diffamierende Veröffentlichungen auf Websites, Rücknahme von Artikeln, die auf Sicherheitsprobleme bei bestimmten Impfstoffen hinwiesen, die Ablehnung von Forschungsstipendien, Entlassungsforderungen, Vorladungen zu Anhörungen oder Disziplinarausschüssen durch Gesundheitsbehörden, Aussetzung der ärztlichen Zulassung und Selbstzensur. Kempner [222] definiert den „abschreckenden Effekt“ ferner in Bezug auf den Einfluss politischer Kontroversen auf die Produktion neuer wissenschaftlicher Erkenntnisse. Es scheint, dass so viele Forscher in einer „institutionellen Zwangsjacke“ [223] gefangen, eingeschränkt und daran gehindert sind, ihre Studien fortzusetzen, während sie Praktiken anwenden, die speziell darauf ausgerichtet sind, die umstrittensten Aspekte ihrer Forschung zu verschleiern und den Konsens und Status quo aufrechtzuerhalten.
Darüber hinaus ist die Öffentlichkeit, wie diese Studie zeigt, durch die Berichterstattung über die medizinische Wissenschaft in der Presse schlecht bedient. Journalisten im medizinischen Bereich werden oft beschuldigt, sensationslüstern, unsachlich und spekulativ zu sein, und es mangelt ihnen an Nachverfolgung und sie legen Interessenkonflikte nicht offen [224,225]. Der Gesundheitsjournalist der New York Times, Aaron E. Carroll, hat sich beispielsweise dafür eingesetzt, dass die Öffentlichkeit die Grippeimpfempfehlungen der CDC befolgt, zu denen auch die Empfehlung gehört, dass sich schwangere Frauen gegen Grippe impfen lassen [226]. Er betrachtet die Beobachtungsstudien, auf die sich die CDC zur Untermauerung dieser Behauptung stützt, daher als schlüssigen Beweis dafür, dass eine Impfung während der Schwangerschaft sowohl für die werdende Mutter als auch für den anfälligen, sich entwickelnden Fötus sicher ist. Doch wenn es um die Risiken des Alkoholkonsums geht, rät Carroll seinen Lesern: „Legen Sie Beobachtungsdaten nicht zu viel Wert“ [227]. Lipworth et al. [228] wagen Sie es, zu behaupten, dass „alternative Medien“ zwar den Status Quo, die Lebensfähigkeit und die Abhängigkeit der Öffentlichkeit von den Mainstream-Medien bedrohen, es jedoch Patienten, Patienten und Klinikern ermöglichen, sich auf der Grundlage von Erfahrungen aus erster Hand an mediengeführten offenen Debatten über gesundheitsbezogene Themen zu beteiligen.
Die Autismus-MMR-Debatte ist tief verwurzelt in den vielen Jahrzehnten der Graswurzelbewegungen, die in den 1990er Jahren ihren Ursprung haben. Sie alle waren motiviert durch das medizinische Gaslighting von Müttern und Vätern, die medizinische Gleichgültigkeit gegenüber ihrem väterlichen Instinkt und die allgemeine soziale Ächtung derjenigen, die der akzeptierten Impforthodoxie etwas vormachen. Über 30 Jahre später, in der Zeit nach COVID-19, haben sich Stereotypisierung, soziale Stigmatisierung, Ächtung, Herablassung und Polarisierung von Eltern, die sich dafür entscheiden, ihre Kinder nicht impfen zu lassen [229], und Impfgeschädigten [230] nur noch verschärft und intensiviert. Wir würden ein Moratorium für die Stigmatisierung und Dichotomisierung der Ungeimpften, der Impfgeschädigten und der Impfkritiker sowie ein Ende der Impfpflicht für Kinder bei der Einschulung vorschlagen. Gesundheitsfreiheit, elterliche Autonomie und eine offene, ehrliche wissenschaftliche Debatte können nur echte Fortschritte im Dienste unserer Kinder, Familien und der Gesellschaft insgesamt fördern. Tatsächlich sagte Aristoteles: „Wissenschaft entsteht aus Neugier.“ Wir würden dies noch erweitern und ausdrücklich erklären, dass sie mit Sicherheit nicht aus institutionellen Interessenkonflikten, Konsens, Zensur, Aufdrängung, Unterdrückung, Apathie oder Gaslighting entstehen kann.
Finanzierung: Diese Forschung erhielt keine spezifischen Zuschüsse von Finanzierungsagenturen im öffentlichen, kommerziellen oder gemeinnützigen Sektor.
Datenverfügbarkeit: Für die im Artikel beschriebene Forschung wurden keine Daten verwendet.
Danksagungen: Beratung, kritische Erkenntnisse und Kommentare zum ersten Entwurf von JB Handley, James Lyons-Weiler, Stephanie Seneff und Elizabeth Clarkson.
Interessenkonflikte: Der/die Autor(en) erklären, dass keine Interessenkonflikte bestehen.
Erklärung zur Urheberschaft: Hammond erstellte die ursprüngliche Studienkonzeption und den ersten Entwurf. Zusätzliche Konzeptentwicklung und Entwurf durch Varia und Hooker. Weiteres Schreiben, Überprüfen und Bearbeiten durch Varia, Hooker und Hammond. Alle Autoren haben das endgültige Manuskript gelesen und freigegeben.
Referenzen
1. Centers for Disease Control and Prevention (CDC). Mumps. (2024) [cited 2024 Aug 15]. Mumps Symptoms and Complications. Available from: https://www.cdc.gov/mumps/signs-symptoms/index.html
2. Centers for Disease Control and Prevention (CDC). Rubella (German Measles, Three-Day Measles). (2024) [cited 2024 Aug 15]. About Rubella. Available from: https://www.cdc.gov/rubella/about/index.html
3. DeStefano, F., & Shimabukuro, T. T. (2019). The MMR vaccine and autism. Annual Review of Virology, 6(1), 585-600. https://doi.org/10.1146/annurev-virology-092818-015515
4. Mathis, A. D. (2024). Measles—United States, January 1, 2020–March 28, 2024. MMWR. Morbidity and Mortality Weekly Report, 73. https://www.cdc.gov/mmwr/volumes/73/wr/mm7314a1.htm?ftag=MSF0951a18
5. Centers for Disease Control and Prevention (CDC). (2005). Elimination of rubella and congenital rubella syndrome--United States, 1969-2004. MMWR. Morbidity & Mortality Weekly Report, 54(11), 279-282. https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5411a5.htm
6. Papania, M. J., Wallace, G. S., Rota, P. A., Icenogle, J. P., Fiebelkorn, A. P., Armstrong, G. L., ... & Seward, J. F. (2014). Elimination of endemic measles, rubella, and congenital rubella syndrome from the Western hemisphere: The US experience. JAMA Pediatrics, 168(2), 148-155. https://doi.org/10.1001/jamapediatrics.2013.4342
7. Tappe, J., Leung, J., Mathis, A. D., Oliver, S. E., & Masters, N. B. (2024). Characteristics of reported mumps cases in the United States: 2018–2023. Vaccine, 42(25), 126143. https://doi.org/10.1016/j.vaccine.2024.07.044
8. Barskey, A. E., Glasser, J. W., & LeBaron, C. W. (2009). Mumps resurgences in the United States: A historical perspective on unexpected elements. Vaccine, 27(44), 6186-6195. https://doi.org/10.1016/j.vaccine.2009.06.109
9. De Serres, G., Markowski, F., Toth, E., Landry, M., Auger, D., Mercier, M., ... & Skowronski, D. M. (2013). Largest measles epidemic in North America in a decade—Quebec, Canada, 2011: Contribution of susceptibility, serendipity, and superspreading events. The Journal of Infectious Diseases, 207(6), 990-998. https://doi.org/10.1093/infdis/jis923
10. Dayan, G. H., Rubin, S., & Plotkin, S. (2008). Mumps outbreaks in vaccinated populations: Are available mumps vaccines effective enough to prevent outbreaks? Clinical Infectious Diseases, 47(11), 1458-1467. https://doi.org/10.1086/591196
11. Poland, G. A., & Jacobson, R. M. (1994). Failure to reach the goal of measles elimination: Apparent paradox of measles infections in immunized persons. Archives of Internal Medicine, 154(16), 1815-1820. https://doi.org/10.1001/archinte.1994.00420160048006
12. Maenner, M. J., Warren, Z., Williams, A. R., Amoakohene, E., Bakian, A. V., Bilder, D. A., ... & Shaw, K. A. (2023). Prevalence and characteristics of autism spectrum disorder among children aged 8 years—Autism and Developmental Disabilities Monitoring Network, 11 sites, United States, 2020. MMWR Surveillance Summaries, 72(2), 1. https://doi.org/10.15585%2Fmmwr.ss7202a1
13. Li, Y., Yan, X., Li, Q., Li, Q., Xu, G., Lu, J., & Yang, W. (2023). Prevalence and trends in diagnosed ADHD among us children and adolescents, 2017-2022. JAMA Network Open, 6(10), e2336872-e2336872. https://doi:10.1001/jamanetworkopen.2023.36872
14. Zahran, H. S., Bailey, C. M., Damon, S. A., Garbe, P. L., & Breysse, P. N. (2018). Vital signs: Asthma in children—United States, 2001–2016. Morbidity & Mortality Weekly Report, 67(5), 149. https://doi.org/10.15585%2Fmmwr.mm6705e1
15. Zablotsky, B., Black, L. I., & Akinbami, L. J. (2023). Diagnosed allergic conditions in children aged 0-17 years: United States, 2021. NCHS Data Brief. No. 459. National Center for Health Statistics. https://www.cdc.gov/nchs/data/databriefs/db459.pdf
16. Ullah, F., & Kaelber, D. C. (2021). Using large aggregated de-identified electronic health record data to determine the prevalence of common chronic diseases in pediatric patients who visited primary care clinics. Academic Pediatrics, 21(6), 1084-1093. https://doi.org/10.1016/j.acap.2021.05.007
17. Killeen, R. M. (2007). Vaccines—one of the greatest medical advances of modern times. Canadian Pharmacists Journal/Revue des Pharmaciens du Canada, 140(2_suppl), S2-S2. https://doi.org/10.3821/1913-701X-140-Sp2.S2
18. Guyer, B., Freedman, M. A., Strobino, D. M., & Sondik, E. J. (2000). Annual summary of vital statistics: Tcrends in the health of Americans during the 20th century. Pediatrics, 106(6), 1307-1317. https://doi.org/10.1542/peds.106.6.1307
19. Bianchi, F. P., Mascipinto, S., Stefanizzi, P., De Nitto, S., Germinario, C., & Tafuri, S. (2021). Long-term immunogenicity after measles vaccine vs. wild infection: An Italian retrospective cohort study. Human Vaccines & Immunotherapeutics, 17(7), 2078-2084. https://doi.org/10.1080/21645515.2020.1871296
20. Horstmann, D. M., Schluederberg, A., Emmons, J. E., Evans, B. K., Randolph, M. F., & Andiman, W. A. (1985). Persistence of vaccine-induced immune responses to rubella: comparison with natural infection. Clinical Infectious Diseases, 7(Supplement_1), S80-S85. https://doi.org/10.1093/clinids/7.Supplement_1.S80
21. Amanna, I. J., Carlson, N. E., & Slifka, M. K. (2007). Duration of humoral immunity to common viral and vaccine antigens. New England Journal of Medicine, 357(19), 1903-1915. https://doi.org/10.1056/nejmoa066092
22. Papania, M., Baughman, A. L., Lee, S., Cheek, J. E., Atkinson, W., Redd, S. C., ... & Markowitz, L. (1999). Increased susceptibility to measles in infants in the United States. Pediatrics, 104(5), e59-e59. https://doi.org/10.1542/peds.104.5.e59
23. Mandomando, I. M., Naniche, D., Pasetti, M. F., Vallès, X., Cuberos, L., Nhacolo, A., ... & Alonso, P. (2008). Measles-specific neutralizing antibodies in rural Mozambique: Seroprevalence and presence in breast milk. American Journal of Tropical Medicine and Hygiene, 79(5), 787-792. https://doi.org/10.4269/ajtmh.2008.79.787
24. Waaijenborg, S., Hahné, S. J., Mollema, L., Smits, G. P., Berbers, G. A., van der Klis, F. R., ... & Wallinga, J. (2013). Waning of maternal antibodies against measles, mumps, rubella, and varicella in communities with contrasting vaccination coverage. The Journal of Infectious Diseases, 208(1), 10-16. https://doi.org/10.1093/infdis/jit143
25. Sasco, A. J., & Paffenbarger JR, R. S. (1985). Measles infection and Parkinson's disease. American Journal of Epidemiology, 122(6), 1017-1031. https://doi.org/10.1093/oxfordjournals.aje.a114183
26. Parodi, S., Crosignani, P., Miligi, L., Nanni, O., Ramazzotti, V., Rodella, S., ... & Stagnaro, E. (2013). Childhood infectious diseases and risk of leukaemia in an adult population. International Journal of Cancer, 133(8), 1892-1899. https://doi.org/10.1002/ijc.28205
27. Kubota, Y., Iso, H., Tamakoshi, A., & JACC Study Group. (2015). Association of measles and mumps with cardiovascular disease: The Japan Collaborative Cohort (JACC) study. Atherosclerosis, 241(2), 682-686. https://doi.org/10.1016/j.atherosclerosis.2015.06.026
28. Montella, M., Dal Maso, L., Crispo, A., Talamini, R., Bidoli, E., Grimaldi, M., ... & Franceschi, S. (2006). Do childhood diseases affect NHL and HL risk? A case-control study from northern and southern Italy. Leukemia Research, 30(8), 917-922. https://doi.org/10.1016/j.leukres.2005.11.020
29. Rosenlund, H., Bergström, A., Alm, J. S., Swartz, J., Scheynius, A., van Hage, M., ... & PARSIFAL Study Group. (2009). Allergic disease and atopic sensitization in children in relation to measles vaccination and measles infection. Pediatrics, 123(3), 771-778. https://doi.org/10.1542/peds.2008-0013
30. Shaheen, S. O., Barker, D. J. P., Heyes, C. B., Shiell, A. W., Aaby, P., Hall, A. J., & Goudiaby, A. (1996). Measles and atopy in Guinea-Bissau. The Lancet, 347(9018), 1792-1796. https://doi.org/10.1016/S0140-6736(96)91617-7
31. Benn, C. S., Amenyogbe, N., Björkman, A., Domínguez-Andrés, J., Fish, E. N., Flanagan, K. L., ... & Aaby, P. (2023). Implications of non-specific effects for testing, approving, and regulating vaccines. Drug Safety, 46(5), 439-448. https://doi.org/10.1007/s40264-023-01295-3
32. Demicheli, V., Rivetti, A., Debalini, M. G., & Di Pietrantonj, C. (2013). Vaccines for measles, mumps and rubella in children. Evidence-Based Child Health: A Cochrane Review Journal, 8(6), 2076-2238. https://doi.org/10.1002/ebch.1948
33. Miller, N. Z. (2021). Vaccines and sudden infant death: An analysis of the VAERS database 1990–2019 and review of the medical literature. Toxicology Reports, 8, 1324-1335. http://dx.doi.org/10.1016/j.toxrep.2021.06.020
34. Centers for Disease Control and Prevention (CDC). CDC vaccine safety. 2024 [cited 2024 Jul 14]. Autism and Vaccines. Available from: https://www.cdc.gov/vaccine- safety/about/autism.html?CDC_AAref_Val=https://www.cdc.gov/vaccinesafety/concerns/autism.html
35. Board on Health Promotion, Disease Prevention, & Immunization Safety Review Committee. (2004). Immunization safety review: Vaccines and autism. Washington (DC): National Academies Press (US) https://doi.org/10.17226/10997
36. Committee to Review Adverse Effects of Vaccines; Institute of Medicine. Adverse effects of vaccines: Evidence and causality. Clayton, E. W., Rusch, E., Ford, A., & Stratton, K. (Eds.). (2012). Adverse effects of vaccines: Evidence and causality. Washington (DC): National Academies Press (US). http://dx.doi.org/10.17226/13164
37. Board on Population Health, Public Health Practice, & Committee on the Assessment of Studies of Health Outcomes Related to the Recommended Childhood Immunization Schedule. (2013). The childhood immunization schedule and safety: Stakeholder concerns, scientific evidence, and future studies. Washington (DC): National Academies Press (US). https://doi.org/10.17226/13563
38. Wakefield, A. J., Murch, S. H., Anthony, A., Linnell, J., Casson, D. M., Malik, M., ... & Walker -Smith, J. A. (1998). RETRACTED: Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. The Lancet, 351(9103), 637-641. https://doi.org/10.1016/s0140- 6736(97)11096-0
39. Murch, S. H., Anthony, A., Casson, D. H., Malik, M., Berelowitz, M., Dhillon, A. P., ... & Walker-Smith, J. A. (2004). Retraction of an interpretation. The Lancet, 363(9411), 750. https://doi.org/10.1016/s0140-6736(04)15715-2
40. Deer, B. (2010). Wakefield’s “autistic enterocolitis” under the microscope. BMJ, 340. https://doi.org/10.1136/bmj.c1127
41. Deer, B. (2011). How the vaccine crisis was meant to make money. BMJ, 342. https://doi.org/10.1136/bmj.c5258
42. Deer, B. (2011). How the case against the MMR vaccine was fixed. BMJ, 342. https://doi.org/10.1136/bmj.c5347
43. Ekbom, A., Adami, H. O., Wakefield, A., & Zack, M. J. T. L. (1994). Perinatal measles infection and subsequent Crohn's disease. The Lancet, 344(8921), 508-510. https://doi.org/10.1016/S0140-6736(94)91898-8
44. Wakefield, A. J., Ekbom, A., Dhillon, A. P., Pittilo, R. M., & Pounder, R. E. (1995). Crohn's disease: Pathogenesis and persistent measles virus infection. Gastroenterology, 108(3), 911-916. https://doi.org/10.1016/0016-5085(95)90467-0
45. Ekbom, A., Daszak, P., Kraaz, W., & Wakefield, A. J. (1996). Crohn's disease after in-utero measles virus exposure. The Lancet, 348(9026), 515-517. https://doi.org/10.1016/s0140-6736(96)04429-7
46. Thompson, N. P., Pounder, R. E., Wakefield, A. J., & Montgomery, S. M. (1995). Is measles vaccination a risk factor for inflammatory bowel disease? The Lancet, 345(8957), 1071-1074. https://doi.org/10.1016/s0140-6736(95)90816-1
47. Wakefield, A. J., Puleston, J. M., Montgomery, S. M., Anthony, A., O'leary, J. J., & Murch, S. H. (2002). The concept of entero-colonic encephalopathy, autism and opioid receptor ligands. Alimentary Pharmacology & Therapeutics, 16(4), 663-674. https://doi.org/10.1046/j.1365-2036.2002.01206.x
48. Wakefield, A. J., Ashwood, P., & Collins, I. (2005). The gut-brain axis in childhood developmental disorders: Viruses and vaccines. Neuropsychiatric Disorders & Infection, 198. https://doi.org/10.1097/00005176-200205001-00004
49. Varia, J., Herbert, M., & Hooker, B. (2024). The neuroimmunology of autism. https://doi.org/10.20944/preprints202411.0618.v1
50. Turville, C., & Golden, I. (2015). Autism and vaccination: The value of the evidence base of a recent metaanalysis. Vaccine, 33(42), 5494-5496. https://doi.org/10.1016/j.vaccine.2015.02.002
51. Buie, T., Campbell, D. B., Fuchs III, G. J., Furuta, G. T., Levy, J., VandeWater, J., ... & Winter, H. (2010). Evaluation, diagnosis, and treatment of gastrointestinal disorders in individuals with ASD: A consensus report. Pediatrics, 125(Supplement_1), S1-S18. https://doi.org/10.1542/peds.2009-1878C
52. Casiday, R. E. (2007). Children's health and the social theory of risk: Insights from the British measles, mumps and rubella (MMR) controversy. Social Science & Medicine, 65(5), 1059-1070. https://doi.org/10.1016/j.socscimed.2007.04.023
53. Shapiro, D., & Hayburn, A. (2024). Medical gaslighting as a mechanism for medical trauma: Case studies and analysis. Current Psychology, 1-14. https://doi.org/10.1007/s12144-024-06935-0
54. Williams, S. J., & Calnan, M. (1996). The ‘limits’ of medicalization? Modern medicine and the lay populace in ‘late’ modernity. Social Science & Medicine, 42(12), 1609-1620. https://doi.org/10.1016/0277-9536(95)00313-4
55. Bennett, P., Celik, F., Winstanley, J., Hunt, B. J., & Pavord, S. (2023). Living with vaccine-induced immune thrombocytopenia and thrombosis: A qualitative study. BMJ Open, 13(7), e072658. http://dx.doi.org/10.1136/bmjopen-2023-072658
56. Fagen, J. L., Shelton, J. A., & Luché-Thayer, J. (2023, December). Medical gaslighting and Lyme disease: The patient experience. In Healthcare (Vol. 12, No. 1, p. 78). MDPI. https://doi.org/10.3390/healthcare12010078
57. Leach, M. (2005). MMR mobilisation: Citizens and science in a British vaccine controversy. The Institute of Development Studies & Partner Organizations. https://hdl.handle.net/20.500.12413/4111
58. Angell, M. (2009). Drug companies & doctors: A story of corruption. The New York Review of Books, 56(1), 8-12. http://www.nybooks.com/articles/22237
59. Mello, M. M., Abiola, S., & Colgrove, J. (2012). Pharmaceutical companies’ role in state vaccination policymaking: The case of human papillomavirus vaccination. American Journal of Public Health, 102(5), 893-898. https://doi.org/10.2105/ajph.2011.300576
60. Lewis, D. L. (2012). Apparent egregious ethical misconduct by British Medical Journal, Brian Deer. UK Research Integrity Office (UKRIO), Reference, (2011-060). https://www.junkscience.com/wp-content/uploads/2012/01/david-lewis-bmj.pdf
61. Sharav, V. (2017). L’Affaire Wakefield: Shades of Dreyfus and BMJ’s descent into tabloid science. Alliance for Human Research Protection. https://ahrp.org/wp-content/uploads/2017/10/LAffaire-Wakefield-Shades-of-Dreyfus-BMJs-Descent-to-Tabloid-Journalism-Vera-Sharav-2017.pdf
62. Mohammed, S. A., Rajashekar, S., Ravindran, S. G., Kakarla, M., Gambo, M. A., Salama, M. Y., ... & Hamid, P. (2022). Does vaccination increase the risk of autism spectrum disorder? Cureus, 14(8). https://doi.org/10.7759/cureus.27921
63. Turville, C., & Golden, I. (2015). Autism and vaccination: The value of the evidence base of a recent metaanalysis. Vaccine, 33(42), 5494-5496. https://doi.org/10.1016/j.vaccine.2015.02.002
64. Poltorak, M., Leach, M., Fairhead, J., & Cassell, J. (2005). ‘MMR talk’ and vaccination choices: An ethnographic study in Brighton. Social Science & Medicine, 61(3), 709-719. https://doi.org/10.1016/j.socscimed.2004.12.014
65. Hviid, A., Hansen, J. V., Frisch, M., & Melbye, M. (2019). Measles, mumps, rubella vaccination and autism: a nationwide cohort study. Annals of Internal Medicine, 170(8), 513-520. https://doi.org/10.7326/m18-2101
66. Jenco, M. AAP News. (2024) [cited 2024 Sep 9]. Study: MMR vaccine not linked to increased autism risk. Available from: https://publications.aap.org/aapnews/news/13925
67. Bracho-Sanchez, E. CNN. (2019) [cited 2024 Aug 1]. MMR vaccine does not cause autism, another study confirms. Available from: https://www.cnn.com/2019/03/04/health/mmr-vaccine-autism-study/index.html
68. Stein, R. NPR. (2019) [cited 2024 Aug 15]. A large study provides more evidence that MMR vaccines don’t cause autism. Available from: https://www.npr.org/sections/health-shots/2019/03/04/699997613/a-large-study-provides-more-evidence-that-mmr-vaccines-dont-cause-autism
69. Geggel, L. Live Science. (2019) [cited 2024 Aug 15]. Confirmed: No link between autism and measles vaccine, even for “at risk” kids. Available from: https://www.livescience.com/64909-measles-vaccine-not-linked-to-autism.html
70. Hoffman, J. New York Times. (2019) [cited 2024 Aug 1]. One more time, with big data: Measles vaccine doesn’t cause autism. Available from: https://www.nytimes.com/2019/03/05/health/measles-vaccine-autism.html
71. Mammoser, G. Healthline. (2024) [cited 2024 Aug 10]. Another massive study finds measles vaccine doesn’t cause autism. Available from: https://web.archive.org/web/20190307053507/https://www.healthline.com/health-news/no-link-found-between-mmr-vaccine-and-autism
72. MedicalNewsToday. Transcripts. (2019) [cited 2024 Aug 1]. MMR vaccine does not cause autism, even in those most at risk. Available from: https://www.medicalnewstoday.com/articles/324619
73. May, B. Psychiatry Advisor. (2019) [cited 2024 Aug 1]. Study again confirms no link between MMR vaccine and autism. Available from: https://www.psychiatryadvisor.com/home/topics/autism-spectrum-disorders/study-again-confirms-no-link-between-mmr-vaccine-and-autismm
74. Paumgarten, N. The New Yorker. (2019) [cited 2024 Aug 1]. The message of measles. Available from: https://www.newyorker.com/magazine/2019/09/02/the-message-of-measles
75. Madsen, K. M., Hviid, A., Vestergaard, M., Schendel, D., Wohlfahrt, J., Thorsen, P., ... & Melbye, M. (2002). A population-based study of measles, mumps, and rubella vaccination and autism. New England Journal of Medicine, 347(19), 1477-1482. https://doi.org/10.1056/nejmoa021134
76. Parner, E. T., Schendel, D. E., & Thorsen, P. (2008). Autism prevalence trends over time in Denmark: Changes in prevalence and age at diagnosis. Archives of Pediatrics & Adolescent Medicine, 162(12), 11501156. https://doi.org/10.1001/archpedi.162.12.1150
77. Kragh Andersen, P., Pohar Perme, M., van Houwelingen, H. C., Cook, R. J., Joly, P., Martinussen, T., ... & Therneau, T. M. (2021). Analysis of time-to-event for observational studies: Guidance to the use of intensity models. Statistics in Medicine, 40(1), 185-211. https://doi.org/10.1002/sim.8757
78. Benkeser, D., Carone, M., & Gilbert, P. B. (2018). Improved estimation of the cumulative incidence of rare outcomes. Statistics in Medicine, 37(2), 280-293. https://doi.org/10.1002/sim.7337
79. Abd ElHafeez, S., D’Arrigo, G., Leonardis, D., Fusaro, M., Tripepi, G., & Roumeliotis, S. (2021). Methods to analyze time-to-event data: The cox regression analysis. Oxidative Medicine & Cellular Longevity, 2021(1), 1302811. https://doi.org/10.1155/2021/1302811
80. Jain, A., Marshall, J., Buikema, A., Bancroft, T., Kelly, J. P., & Newschaffer, C. J. (2015). Autism occurrence by MMR vaccine status among US children with older siblings with and without autism. JAMA, 313(15), 1534-1540. https://doi.org/10.1001/jama.2015.3077
81. Betancur, C. (2011). Etiological heterogeneity in autism spectrum disorders: More than 100 genetic and genomic disorders and still counting. Brain Research, 1380, 42-77. https://doi.org/10.1016/j.brainres.2010.11.078
82. Hallmayer, J., Cleveland, S., Torres, A., Phillips, J., Cohen, B., Torigoe, T., ... & Risch, N. (2011). Genetic heritability and shared environmental factors among twin pairs with autism. Archives of General Psychiatry, 68(11), 1095-1102. https://doi:10.1001/archgenpsychiatry.2011.76
83. Gaugler, T., Klei, L., Sanders, S. J., Bodea, C. A., Goldberg, A. P., Lee, A. B., ... & Buxbaum, J. D. (2014). Most genetic risk for autism resides with common variation. Nature Genetics, 46(8), 881-885. https://doi.org/10.1038/ng.3039
84. Hocking, M. C., Albee, M. V., Kim, M., Berman, J. I., Fisher, M. J., Roberts, T. P. L., & Blaskey, L. (2024). Social challenges, autism spectrum disorder, and attention deficit/hyperactivity disorder in youth with neurofibromatosis type I. Applied Neuropsychology: Child, 1-9. https://doi.org/10.1080/21622965.2024.2365383
85. Wiznitzer, M. (2004). Autism and tuberous sclerosis. Journal of Child Neurology, 19(9), 675-679 https://doi.org/10.1177/08830738040190090701
86. Peters, S. U., Beaudet, A. L., Madduri, N., & Bacino, C. A. (2004). Autism in Angelman syndrome: Implications for autism research. Clinical Genetics, 66(6), 530-536. https://doi.org/10.1111/j.1399-0004.2004.00362.x
87. Abbeduto, L., McDuffie, A., & Thurman, A. J. (2014). The fragile X syndrome–autism comorbidity: What do we really know? Frontiers in Genetics, 5, 355. https://doi.org/10.3389/fgene.2014.00355
88. Bennett, J. A., Germani, T., Haqq, A. M., & Zwaigenbaum, L. (2015). Autism spectrum disorder in Prader– Willi syndrome: A systematic review. American Journal of Medical Genetics Part A, 167(12), 2936-2944. https://doi.org/10.1002/ajmg.a.37286
89. Reilly, C. (2009). Autism spectrum disorders in Down syndrome: A review. Research in Autism Spectrum Disorders, 3(4), 829-839. https://doi.org/10.1016/j.rasd.2009.01.012
90. Vorstman, J. A., Morcus, M. E., Duijff, S. N., Klaassen, P. W., Beemer, F. A., Swaab, H., ... & van Engeland, Herman. (2006). The 22q11. 2 deletion in children: high rate of autistic disorders and early onset of psychotic symptoms. Journal of the American Academy of Child & Adolescent Psychiatry, 45(9), 1104-1113. https://doi.org/10.1097/01.chi.0000228131.56956.c1
91. Bjørklund, G., Mkhitaryan, M., Sahakyan, E., Fereshetyan, K., Meguid, N. A., Hemimi, M., ... & Yenkoyan, K. (2024). Linking environmental chemicals to neuroinflammation and autism spectrum disorder: Mechanisms and implications for prevention. Molecular Neurobiology, 1-13. https://doi.org/10.1007/s12035-024-03941-y
92. Park, S. K., Tao, Y., Meeker, J. D., Harlow, S. D., & Mukherjee, B. (2014). Environmental risk score as a new tool to examine multi-pollutants in epidemiologic research: an example from the NHANES study using serum lipid levels. PloS One, 9(6), e98632. https://doi.org/10.1371/journal.pone.0098632
93. Liu, J., & Lewis, G. (2014). Environmental toxicity and poor cognitive outcomes in children and adults. Journal of Environmental Health, 76(6), 130. https://pubmed.ncbi.nlm.nih.gov/24645424/
94. Maitre, L., Bustamante, M., Hernández-Ferrer, C., Thiel, D., Lau, C. H. E., Siskos, A. P., ... & Vrijheid, M. (2022). Multi-omics signatures of the human early life exposome. Nature Communications, 13(1), 7024. https://doi.org/10.1038/s41467-022-34422-2
95. Palmer, R. F., Kattari, D., Rincon, R., & Miller, C. S. (2024). Assessing chemical intolerance in parents predicts the risk of autism and ADHD in their children. Journal of Xenobiotics, 14(1), 350-367. https://doi.org/10.3390/jox14010022
96. Merriam-Webster. Definition of the verb “lie”, meaning number two. (2024) [cited 2014 Aug 19]. Available from: https://www.merriam-webster.com/dictionary/lie
97. Glickman, G., Harrison, E., & Dobkins, K. (2017). Vaccination rates among younger siblings of children with autism. New England Journal of Medicine, 377(11), 1099-1101. https://doi.org/10.1056/nejmc1708223
98. Zerbo, O., Modaressi, S., Goddard, K., Lewis, E., Fireman, B. H., Daley, M. F., ... & Klein, N. P. (2018). Vaccination patterns in children after autism spectrum disorder diagnosis and in their younger siblings. JAMA Pediatrics, 172(5), 469-475. https://doi.org/10.1001/jamapediatrics.2018.0082
99. Kuwaik, G. A., Roberts, W., Zwaigenbaum, L., Bryson, S., Smith, I. M., Szatmari, P., ... & Brian, J. (2014). Immunization uptake in younger siblings of children with autism spectrum disorder. Autism, 18(2), 148155. https://doi.org/10.1177/1362361312459111
100. Jain, A., Marshall, J., Buikema, A., Bancroft, T., Kelly, J. P., & Newschaffer, C. J. (2015). Autism occurrence by MMR vaccine status among US children with older siblings with and without autism. JAMA, 313(15), 1534-1540. https://doi.org/10.1001/jama.2015.3077
101. European Centre for Disease Prevention and Control (ECDC). ECDC vaccine scheduler. (2024) [cited 2024 Jul 12]. Denmark: Recommended vaccinations. Available from: https://vaccine-schedule.ecdc.europa.eu/Scheduler/ByCountry?SelectedCountryId=58&IncludeChildAgeGroup=true&IncludeAdultAgeGroup=true&SelectedVersionId=60
102. Statens Serum Institut. Danish childhood vaccination program vaccination offers protection. 13th ed. Sundhedsstyrelsen. (2024) [cited 2024 Jul 2]. Available from: https://www.sst.dk/-Engelsk.ashx /media/Udgivelser/2023/Boernevaccination/Pjecer/Boernevaccinationsprogrammet-i-Danmark-2022-Engelsk.ashx
103. Ingels, H., Rasmussen, J., Andersen, P. H., Harboe, Z. B., Glismann, S., Konradsen, H., ... & Lambertsen, L. (2012). Impact of pneumococcal vaccination in Denmark during the first 3 years after PCV introduction in the childhood immunization programme. Vaccine, 30(26), 3944-3950. https://doi.org/10.1016/j.vaccine.2012.03.060
104. Harboe, Z. B., Dalby, T., Weinberger, D. M., Benfield, T., Mølbak, K., Slotved, H. C., ... & Valentiner-Branth, P. (2014). Impact of 13-valent pneumococcal conjugate vaccination in invasive pneumococcal disease incidence and mortality. Clinical Infectious Diseases, 59(8), 1066-1073. https://doi.org/10.1093/cid/ciu524
105. Wójcik, O. P., Simonsen, J., Mølbak, K., & Valentiner-Branth, P. (2013). Validation of the 5-year tetanus, diphtheria, pertussis and polio booster vaccination in the Danish childhood vaccination database. Vaccine, 31(6), 955-959. https://doi.org/10.1016/j.vaccine.2012.11.100
106. Harder, K. M., Cowan, S., Eriksen, M. B., Krarup, H. B., & Christensen, P. B. (2011). Universal screening for hepatitis B among pregnant women led to 96% vaccination coverage among newborns of HBsAg positive mothers in Denmark. Vaccine, 29(50), 9303-9307. https://doi.org/10.1016/j.vaccine.2011.10.028
107. Centers for Disease Control and Prevention (CDC). CDC Vaccines & immunizations. (2013). Recommended immunization schedule for persons age 0 through 18 years. Available from: https://web.archive.org/web/20130203110629/https://www.cdc.gov/vaccines/schedules/hcp/imz/child-adolescent.html
108. U.S. Food & Drug Administration (FDA). (2023) [cited 2024 Sep 15]. Gardasil. Available from: https://www.fda.gov/vaccines-blood-biologics/vaccines/gardasil
109. World Health Organization (WHO). WHO International. (2018) [cited 2024 Mar 18]. Human papillomavirus (HPV). Available from: https://web.archive.org/web/20190724085659/https://www.ssi.dk/vaccinationer/boernevaccination/vaccination-mod-livmoderhalskraeft
110. Statens Serum Institut. (2018) [cited 2024 Aug 19]. Vaccination against cervical cancer (HPV). Available from: https://www.ssi.dk/vaccinationer/boernevaccination/vaccination-mod-livmoderhalskraeft
111. Turville, C., & Golden, I. (2015). Autism and vaccination: The value of the evidence base of a recent metaanalysis. Vaccine, 33(42), 5494-5496. https://doi.org/10.1016/j.vaccine.2015.02.002
112. Sørup, S., Jensen, A. K., Aaby, P., & Benn, C. S. (2019). Revaccination with measles-mumps-rubella vaccine and infectious disease morbidity: A Danish register-based cohort study. Clinical Infectious Diseases, 68(2), 282-290. https://doi.org/10.1093/cid/ciy433
113. Sørup, S., Jensen, A. K., Aaby, P., & Benn, C. S. (2019). Revaccination with measles-mumps-rubella vaccine and infectious disease morbidity: A Danish register-based cohort study. Clinical Infectious Diseases, 68(2), 282-290. https://doi.org/10.1093/cid/ciy433
114. Davidkin, I., Peltola, H., Leinikki, P., & Valle, M. (2000). Duration of rubella immunity induced by twodose measles, mumps and rubella (MMR) vaccination. A 15-year follow-up in Finland. Vaccine, 18(27), 3106-3112. https://doi.org/10.1016/S0264-410X(00)00139-0
115. Paunio, M., Heinonen, O. P., Virtanen, M., Leinikki, P., Patja, A., & Peltola, H. (2000). Measles history and atopic diseases: A population-based cross-sectional study. JAMA, 283(3), 343-346. https://doi.org/10.1001/jama.283.3.343
116. U.S. Food & Drug Administration (FDA). U.S. Food & Drug Administration (FDA). (2022) [cited 2024 Sep 15]. GlaxoSmithKline Biologicals SA, Priorix Package Insert. Available from: https://web.archive.org/web/20240713033807/https://www.fda.gov/media/151707/download
117. Sørup, S., Jensen, A. K., Aaby, P., & Benn, C. S. (2019). Revaccination with measles-mumps-rubella vaccine and infectious disease morbidity: A Danish register-based cohort study. Clinical Infectious Diseases, 68(2), 282-290. https://doi.org/10.1093/cid/ciy433
118. Gillet, Y., Habermehl, P., Thomas, S., Eymin, C., & Fiquet, A. (2009). Immunogenicity and safety of concomitant administration of a measles, mumps and rubella vaccine (MM-RvaxPro®) and a varicella vaccine (VARIVAX®) by intramuscular or subcutaneous routes at separate injection sites: A randomised clinical trial. BMC Medicine, 7, 1-11. https://doi.org/10.1186/1741-7015-7-16
119. European Commission. Sanofi Pasteur, M-M-RVAXPRO Package Insert. (2024) [cited 2024 Aug 19]. Available from: https://ec.europa.eu/health/documents/community-register/2010/2010090688568/anx_88568_en.pdf
120. Statens Serum Institut. (2024) [cited 2024 Aug 19]. Uge 24 – 2013. Available from: https://www.ssi.dk/aktuelt/nyhedsbreve/epi-nyt/2013/uge-24---2013
121. Benn, C. S. (MD, PhD) Chair of Health Sciences, Department of Clinical Research, Danish Institute for Advanced Study (DIAS) University of Southern Denmark (personal communication, August 19, 2024).
122. Statens Serum Institut. (2008) [cited 2024 Aug 19]. Pneumokokvaccine I Det Danske Børnevaccinationsprogram. Available from: https://www.ssi.dk/- /media/arkiv/dk/aktuelt/nyhedsbreve/epi-nyt/2008/2008-pdf/epi-nyt---2008---uge-38.pdf
123. Parner, E. T., Schendel, D. E., & Thorsen, P. (2008). Autism prevalence trends over time in Denmark: Changes in prevalence and age at diagnosis. Archives of Pediatrics & Adolescent Medicine, 162(12), 11501156. https://doi.org/10.1001/archpedi.162.12.1150
124. Statens Serum Institut. (2008) [cited 2024 Aug 19]. MMR 2 Vaccination Advanced to 4 Years. Available from: https://web.archive.org/web/20240816180533/https://en.ssi.dk/-/media/arkiv/uk/news/epi-news/2008/pdf/epi-news---2008---no-9.pdf
125. Knuesel, I., Chicha, L., Britschgi, M., Schobel, S. A., Bodmer, M., Hellings, J. A., ... & Prinssen, E. P. (2014). Maternal immune activation and abnormal brain development across CNS disorders. Nature Reviews Neurology, 10(11), 643-660. https://doi.org/10.1038/nrneurol.2014.187
126. Wu, W. L., Hsiao, E. Y., Yan, Z., Mazmanian, S. K., & Patterson, P. H. (2017). The placental interleukin-6 signaling controls fetal brain development and behavior. Brain, Behavior, & Immunity, 62, 11-23. https://doi.org/10.1016/j.bbi.2016.11.007
127. Zerbo, O., Qian, Y., Yoshida, C., Fireman, B. H., Klein, N. P., & Croen, L. A. (2017). Association between influenza infection and vaccination during pregnancy and risk of autism spectrum disorder. JAMA Pediatrics, 171(1), e163609-e163609. https://doi.org/10.1001/jamapediatrics.2016.3609
128. Hooker, B. S. (2017). Influenza vaccination in the first trimester of pregnancy and risk of autism spectrum disorder. JAMA Pediatrics, 171(6), 600-600. https://doi.org/10.1001/jamapediatrics.2017.0734
129. Jorgensen, P., Mereckiene, J., Cotter, S., Johansen, K., Tsolova, S., & Brown, C. (2018). How close are countries of the WHO European Region to achieving the goal of vaccinating 75% of key risk groups against influenza? Results from national surveys on seasonal influenza vaccination programmes, 2008/2009 to 2014/2015. Vaccine, 36(4), 442-452. https://doi.org/10.1016/j.vaccine.2017.12.019
130. Mølgaard-Nielsen, D., Fischer, T. K., Krause, T. G., & Hviid, A. (2019). Effectiveness of maternal immunization with trivalent inactivated influenza vaccine in pregnant women and their infants. Journal of Internal Medicine, 286(4), 469-480. https://doi.org/10.1111/joim.12947/p>
131. Nakken, C. S., Skovdal, M., Nellums, L. B., Friedland, J. S., Hargreaves, S., & Norredam, M. (2018). Vaccination status and needs of asylum-seeking children in Denmark: A retrospective data analysis. Public Health, 158, 110-116. https://doi.org/10.1016/j.puhe.2018.02.018
132. Cherri, Z., Lau, K., Nellums, L. B., Himmels, J., Deal, A., McGuire, E., ... & Hargreaves, S. (2024). The immune status of migrant populations in Europe and implications for vaccine-preventable disease control: A systematic review and meta-analysis. Journal of Travel Medicine, taae033. https://doi.org/10.1093/jtm/taae033
133. Holt, N., Mygind, A., & Bro, F. (2017). Danish MMR vaccination coverage is considerably higher than reported. Danish Medical Journal, 64(2), A5345. https://ugeskriftet.dk/dmj/danish-mmr-vaccination-coverage-considerably-higher-reported
134. Schendel, D. E., & Thorsteinsson, E. (2018). Cumulative incidence of autism into adulthood for birth cohorts in Denmark, 1980-2012. JAMA, 320(17), 1811-1813. https://doi.org/10.1001/jama.2018.11328
135. Centers for Disease Control and Prevention (CDC). About Autism Spectrum Disorder (ASD). (2024) [cited 2024 Jul 15]. Data and Statistics on Autism Spectrum Disorder. Available from: https://www.cdc.gov/autism/data-research/index.html
136. Munafò, M. R., Nosek, B. A., Bishop, D. V., Button, K. S., Chambers, C. D., Percie du Sert, N., ... & Ioannidis, J. (2017). A manifesto for reproducible science. Nature Human Behavior, 1(1), 1-9. https://doi.org/10.1038/s41562-016-0021
137. Clarkson, E (PhD), Chief Statistician at the National Institute for Aviation Research (NIAR) and Senior Research Engineer and Chief Statistician for the National Center for Advanced Materials Performance (NCAMP). Wichita State University (personal communication, April 4, 2019)./p>
138. Centers for Disease Control and Prevention (CDC). CDC Vaccines & Immunizations. 2023. Child and Adolescent Immunization Schedule by Age. Available from: https://www.cdc.gov/vaccines/hcp/imz-schedules/child-adolescent-age.html
139. Centers for Disease Control and Prevention (CDC). CDC Pregnancy and Vaccination. 2024 [cited 2024 Aug 15]. Vaccine recommendations before, during, and after pregnancy. Available from: https://www.cdc.gov/vaccines-pregnancy/recommended-vaccines/index.html
140. Bennett J. (2019) Shortcomings in the latest MMR vaccination and autism study: A healthcare administrator’s response. Science, Public Health Policy & the Law. 1, 2019-2024. https://publichealthpolicyjournal.com/shortcomings-in-the-latest-mmr-vaccination-and-autism-study-a-healthcare-administrators-response/
141. BioSpace. (2024) [cited 2024 Nov 2]. Biologics market size to hit around USD 1. 37 trillion by 2033. Available from: https://www.biospace.com/biologics-market-size-to-hit-around-usd-1-37-trillion-by-2033
142. Precedence Research. (2024) [cited 2024 Nov 2]. Vaccines market size, share, and trends 2024 to 2034. Available from: https://www.precedenceresearch.com/vaccines-market
143. Allied Market Research. (2022) [cited 2024 Nov 2]. Mumps vaccine market size, share, competitive landscape and trend analysis report, by age group, by distribution channel: Global opportunity analysis and Industry Forecast, 2021-2031. Available from: https://www.alliedmarketresearch.com/mumps-vaccine-market-A15401
144. Parker, E. M., Zhu, B. P., Li, Z., Puddy, R. W., Kelly, M. A., Scott, C., ... & Stephens, J. W. (2024). Domains of excellence: A CDC framework for developing high-quality, impact-driven public health science publications. Journal of Public Health Management & Practice, 30(1), 72-78. https://doi.org/10.1097/phh.0000000000001815
145. Kern, J. K., Geier, D. A., Deth, R. C., Sykes, L. K., Hooker, B. S., Love, J. M., ... & Geier, M. R. (2017). Systematic assessment of research on autism spectrum disorder (ASD) and mercury reveals conflicts of interest and the need for transparency in autism research. Science & Engineering Ethics, 23, 1691-1718. https://doi.org/10.1007/s11948-017-9983-2
146. Lenzer, J. (2015). Centers for Disease Control and Prevention: Protecting the private good? BMJ, 350. https://doi.org/10.1136/bmj.h2362/p>
147. Huntoon, L. R. (2020). CDC: Bias and disturbing conflicts of interest. Journal of American Physicians & Surgeons, 23, 66-69. https://www.jpands.org/vol25no3/huntoon.pdf
148. Miller, N. Z., & Goldman, G. S. (2022). Case study: Varicella vaccine and the suppression of data. Journal of American Physicians and Surgeons, 27(1). https://jpands.org/vol27no1/miller.pdf
149. Hooker, B. S. (2018). Reanalysis of CDC data on autism incidence and time of first MMR vaccination. Journal of American Physicians & Surgeons, 23(4), 105-110. https://www.jpands.org/vol23no4/hooker.pdf
150. Hooker, B. S. (2017). CDC data manipulation exposed: Four years later. Journal of American Physicians & Surgeons, 22(4), 119-121. https://www.jpands.org/vol22no4/hooker.pdf
151. Nissen, S. E. (2017). Conflicts of interest and professional medical associations: Progress and remaining challenges. JAMA, 317(17), 1737-1738. http://dx.doi.org/10.1001/jama.2017.2516
152. Deirdre, I. Fox News. (2010) [cited 2024 Nov 2]. Conflict of children’s interest inside the American academy of pediatrics. Available from: https://www.foxnews.com/health/conflict-of-childrens-interest-inside-the-american-academy-of-pediatrics
153. Steinbrook, R., Kassirer, J. P., & Angell, M. (2015). Justifying conflicts of interest in medical journals: A very bad idea. BMJ, 350. https://doi.org/10.1136/bmj.h2942/p>
154. Angell M, Relman A. S. New York Times. (2004) [cited 2024 Nov 1]. Physicians, educate yourselves. Available from: https://www.nytimes.com/2004/12/30/opinion/physicians-educate-yourselves-017566.html
155. Angell, M. (2009). Drug companies & doctors: A story of corruption. The New York Review of Books, 56(1), 8-12. https://www.nybooks.com/articles/2009/01/15/drug-companies-doctorsa-story-of-corruption/.
156. Statens Serum Institut. (2022) [cited 2024 Jul 2]. Vaccine research. Available from: https://en.ssi.dk/research/center-for-vaccine-research
157. Statens Serum Institut. (2019) [cited 2024 Aug 19]. No Association between MMR vaccine and autism. Available from: https://en.ssi.dk/news/news/2019/no-association-between-mmr-vaccine-and-autism
158. Novo Nordisk Foundation. (2024) [cited 2024 Aug 2]. Who are we? Available from: https://novonordiskfonden.dk/en/who-we-are/
159. International Committee of Medical Journal Editors. ICMJE Form for disclosure of potential conflicts of interest. (2019) [cited 2024 Aug 1]. Available from: https://rmed.acponline.org/authors/conflictFormServlet/M18-2101/ICMJE/M18-2101-Conflicts.pdf
160. Indenrigs-OG Sundhedsministeriet (2022) [cited 2024 Aug 1]. Minister for the interior and health of Denmark. Available from: https://www.ism.dk/english
161. Novo Nordisk Foundation. (2022) [cited 2024 Aug 21]. Ownership. Available from: https://novonordiskfonden.dk/en/who-we-are/ownership/
162. Novo Nordisk A/S. (2024) [cited 2024 Aug 2]. Corporate governance. Available from: https://www.novonordisk.com/about/corporate-governance.html
163. CompaniesMarketCap. Global ranking. (2024) [cited 2024 Aug 1]. Market capitalization of Novo Nordisk (NVO). Available from: https://companiesmarketcap.com/novo-nordisk/marketcap/#google_vignette
164. Novo Holdings. (2024) [cited 2024 Aug 21]. Corporate governance. Available from: https://www.novonordisk.com/about/corporate-governance.html
165. Novo Holdings. (2021) [cited 2024 Aug 21]. Investments. Available from: https://novoholdings.dk/investments
166. Novo Holdings. (2021) [cited 2024 Aug 21]. Joining the fight against COVID-19 while running a life-saving business. Available from: https://novoholdings.dk/news/joining-the-fight-against-covid-19-while-running-a-life-saving-business
167. Novo Nordisk Foundation Initiative for Vaccines and Immunity (NIVI). (2023) [cited 2024 Aug 21]. Projekter og initiativer. Available from: https://novonordiskfonden.dk/projekter/novo-nordisk-foundation-initiative-for-vaccines-and-immunity-nivi
168. University of Copenhagen. (2023) [cited 2024 Aug 21]. New initiative puts Danish vaccine science on the global map. Available from: https://healthsciences.ku.dk/newsfaculty-news/2023/12/new-initiative-puts-danish-vaccine-science-on-the-global-map
169. NIVI Novo Nordisk Foundation Initiative for Vaccines and Immunity. (2024) [cited 2024 Aug 23]. About the initiative. Available from: https://nivi.ku.dk/about-nivi//p>
170. Novo Nordisk Foundation. (2024) [cited 2024 Aug 2]. The Novo Nordisk Foundation Vaccine Accelerator (NVAC). Available from: https://novonordiskfonden.dk/en/projects/the-novo-nordisk-foundation-vaccine-accelerator-nvac/
171. Statens Serum Institut. (2018) [cited 2024 Aug 19]. Vaccination against cervical cancer (HPV). Available from: https://www.ssi.dk/vaccinationer/boernevaccination/vaccination-mod-livmoderhalskraeft
172. Olsen, S. F., Halldorsson, T. I., Thorne-Lyman, A. L., Strøm, M., Gørtz, S., Granstrøm, C., ... & Zhou, W. (2018). Plasma concentrations of long chain N-3 fatty acids in early and mid -pregnancy and risk of early preterm birth. EBioMedicine, 35, 325-333. https://doi.org/10.1016/j.ebiom.2018.07.009
173. Novo Nordisk Foundation. (2019) [cited 2024 Aug 2]. The Novo Nordisk Foundation awards grants to 12 excellent research leaders within bioscience and basic biomedicine. Available from: https://researchleaderprogramme.com/news/the-novo-nordisk-foundation-awards-grants-to-12-excellent-research-leaders-within-bioscience-and-basic-biomedicine
174. Statens Serum Institut. (2023) [cited 2024 Aug 19]. New research sheds light on genetics of placenta growth. Available from: https://en.ssi.dk/news/news/2023/new-research-sheds-light-on-genetics-of-placenta-growth
175. Statens Serum Institut. (2024) [cited 2024 Jul 2]. SSI researcher receives multi-million kroner grant from the Novo Nordisk Foundation. Available from: https://en.ssi.dk/news/news/2019/ssi-researcher-receives-multi-million-kroner-grant-from-the-novo-nordisk-foundation
176. Statens Serum Institut. (2024) [cited 2024 Jul 2]. Babies’ own genes influence when they are born. Available from: https://en.ssi.dk/news/news/2019/babies-own-genes-influence-when-they-are-born
177. Statens Serum Institut. (2023) [cited 2024 Aug 2]. The Danish national biobank. Available from: https://en.ssi.dk/research/the-danish-national-biobank
178. Angell, M., & Relman, A. S. (2002). Patents, profits & American medicine: Conflicts of interest in the testing & marketing of new drugs. Daedalus, 131(2), 102-111. https://www.jstor.org/stable/20027764
179. Kennedy Jr, R. F. (2015). Thimerosal: Let the science speak: The evidence supporting the immediate removal of mercury—A known neurotoxin—From vaccines. Simon & Schuster./p>
180. Schuemie, M. J., Hripcsak, G., Ryan, P. B., Madigan, D., & Suchard, M. A. (2018). Empirical confidence interval calibration for population-level effect estimation studies in observational healthcare data. Proceedings of the National Academy of Sciences, 115(11), 2571-2577. https://doi.org/10.1073/pnas.1708282114
181. Hviid, A., Stellfeld, M., Wohlfahrt, J., & Melbye, M. (2003). Association between thimerosal-containing vaccine and autism. JAMA, 290(13), 1763-1766. https://doi.org/10.1001/jama.290.13.1763
182. Hviid, A., Stellfeld, M., Wohlfahrt, J., & Melbye, M. (2004). Childhood vaccination and type 1 diabetes. New England Journal of Medicine, 350(14), 1398-1404. https://doi.org/10.1056/nejmoa032665
183. Vestergaard, M., Hviid, A., Madsen, K. M., Wohlfahrt, J., Thorsen, P., Schendel, D., ... & Olsen, J. (2004). MMR vaccination and febrile seizures: Evaluation of susceptible subgroups and long-term prognosis. JAMA, 292(3), 351-357. https://doi.org/10.1001/jama.292.3.351
184. Hviid, A., Melbye, M., & Pasternak, B. (2013). Use of selective serotonin reuptake inhibitors during pregnancy and risk of autism. New England Journal of Medicine, 369(25), 2406-2415. https://doi.org/10.1056/nejmoa1301449
185. Pasternak, B., Svanström, H., & Hviid, A. (2013). Ondansetron in pregnancy and risk of adverse fetal outcomes. New England Journal of Medicine, 368(9), 814-823. https://doi.org/10.1056/nejmoa1211035
186. Geier, D. A., King, P. G., Hooker, B. S., Dórea, J. G., Kern, J. K., Sykes, L. K., & Geier, M. R. (2015). Thimerosal: Clinical, epidemiologic and biochemical studies. Clinica Chimica acta, 444, 212-220. https://doi.org/10.1016/j.cca.2015.02.030
187. Kern, J., Geier, D., Audhya, T., King, P., Sykes, L., & Geier, M. (2012). Evidence of parallels between mercury intoxication and the brain pathology in autism. Acta Neurobiologiae Experimentalis, 72(2), 113-153. https://doi.org/10.55782/ane-2012-1887
188. Mezzacappa, A., Lasica, P. A., Gianfagna, F., Cazas, O., Hardy, P., Falissard, B., ... & Gressier, F. (2017). Risk for autism spectrum disorders according to period of prenatal antidepressant exposure: A systematic review and meta-analysis. JAMA Pediatrics, 171(6), 555-563. https://doi.org/10.1001/jamapediatrics.2017.0124
189. Kennedy, D. (2016). Ondansetron and pregnancy: Understanding the data. Obstetric Medicine, 9(1), 28-33. https://doi.org/10.1177/1753495X15621154
190. Kirby, D. (2008). The vaccine-autism court document every American should read. Huffington Post. https://www.jeremyrhammond.com/wp-content/uploads/2019/10/080226-Vaccine-Autism-Court-Document-Kirby-HuffPost.pdf
191. Transcripts. (2008) [cited 2024 Aug 1]. Unraveling the mystery of autism; talking with the CDC director; stories of children with autism; aging with autism. Available from: http://transcripts.cnn.com/TRANSCRIPTS/0803/29/hcsg.01.html
192. Reuters. Reuters. (2009) [cited 2024 Aug 21]. Former CDC head lands vaccine job at Merck. Available from: https://www.reuters.com/article/us-merck-gerberding/former-cdc-head-lands-vaccine-job-at-merck-idUSTRE5BK2K520091221/
193. Merck. (2022) [cited 2024 Aug 21]. Dr. Julie L. Gerberding to Retire from Merck. Available from: https://www.merck.com/news/dr-julie-l-gerberding-to-retire-from-merck/
194. Hallmayer, J., Cleveland, S., Torres, A., Phillips, J., Cohen, B., Torigoe, T., ... & Risch, N. (2011). Genetic heritability and shared environmental factors among twin pairs with autism. Archives of General Psychiatry, 68(11), 1095-1102. https://doi.org/10.1001/archgenpsychiatry.2011.76
195. Bradstreet, J. (2004). Biological evidence of significant vaccine related side-effects resulting in neurodevelopmental disorders. Presentation to the Vaccine Safety Committee of the Institute of Medicine, The National Academies of Science, 9. https://www.amalgam-informationen.de/dokument/Bradstreet.pdf
196. Maitre, L., Bustamante, M., Hernández-Ferrer, C., Thiel, D., Lau, C. H. E., Siskos, A. P., ... & Vrijheid, M. (2022). Multi-omics signatures of the human early life exposome. Nature Communications, 13(1), 7024. https://doi.org/10.1038/s41467-022-34422-2
197. Laugesen, K., Mengel-From, J., Christensen, K., Olsen, J., Hougaard, D. M., Boding, L., ... & Sørensen, H. T. (2023). A review of major Danish biobanks: Advantages and possibilities of health research in Denmark. Clinical Epidemiology, 213-239. https://doi.org/10.2147/CLEP.S392416
198. Attkisson, S. (2018) [cited 2024 Aug 13]. CDC: “Possibility” that vaccines rarely trigger autism. Available from: https://sharylattkisson.com/2018/12/cdc-possibility-that-vaccines-rarely-trigger-autism/
199. Price, C. S., Thompson, W. W., Goodson, B., Weintraub, E. S., Croen, L. A., Hinrichsen, V. L., ... & DeStefano, F. (2010). Prenatal and infant exposure to thimerosal from vaccines and immunoglobulins and risk of autism. Pediatrics, 126(4), 656-664. https://doi.org/10.1542/peds.2010-0309
200. Janiaud, P., Agarwal, A., Tzoulaki, I., Theodoratou, E., Tsilidis, K. K., Evangelou, E., & Ioannidis, J. P. (2021). Validity of observational evidence on putative risk and protective factors: appraisal of 3744 meta-analyses on 57 topics. BMC Medicine, 19, 1-17. https://doi.org/10.1186/s12916-021-02020-6
201. Ioannidis, J. P. (2016). Why most clinical research is not useful. PLoS medicine, 13(6), e1002049. https://doi.org/10.1371/journal.pmed.1002049
202. Kennedy. R. F, Hooker B. (2023) Vax-Unvax: Let the science speak. Skyhorse Publishing.
203. Chandler, J., Cumpston, M., Li, T., Page, M. J., & Welch, V. J. H. W. (2019). Cochrane handbook for systematic reviews of interventions. Hoboken, Wiley. http://dx.doi.org/10.1002/9781119536604
204. Barnes, H. J., Ragnarsson, G., & Alván, G. (2009). Quality and safety considerations for recombinant biological medicines: A regulatory perspective. International Journal of Risk & Safety in Medicine, 21(1-2), 13-22. http://dx.doi.org/10.3233/JRS-2009-0454
205. Valiant, W. G., Cai, K., & Vallone, P. M. (2022). A history of adventitious agent contamination and the current methods to detect and remove them from pharmaceutical products. Biologicals, 80, 6-17. https://doi.org/10.1016/j.biologicals.2022.10.002
206. 1] Chooi, W. H., Ng, P. W., Hussain, Z., Ming, L. C., Ibrahim, B., & Koh, D. (2022). Vaccine contamination: Causes and control. Vaccine, 40(12), 1699. https://doi.org/10.1016/j.vaccine.2022.02.034
207. Aranha, H., & Solutions, C. P. (2011). Virus safety of biopharmaceuticals. Contract Pharma, 13. https://www.contractpharma.com/virus-safety-of-biopharmaceuticals/
208. English, J. M. (1995). The rights and wrongs of measles vaccination. British Homoeopathic Journal, 84(3), 156-163. https://doi.org/10.1016/S0007-0785(05)80068-7
209. Price, D., Jefferson, T., & Demicheli, V. (2004). Methodological issues arising from systematic reviews of the evidence of safety of vaccines. Vaccine, 22(15-16), 2080-2084. https://doi.org/10.1016/j.vaccine.2004.01.009
210. Halvorsen, R. (2007). The Truth About Vaccines: How we are used as guinea pigs without knowing it. Gibson Square. 211. McKinlay, J. B., & McKinlay, S. M. (1977). The questionable contribution of medical measures to the decline of mortality in the United States in the twentieth century. The Milbank Memorial Fund Quarterly. Health & Society, 405-428. http://ftp.columbia.edu/itc/hs/pubhealth/rosner/g8965/client_edit/readings/week_2/mckinlay.pdf
212. Armstrong, G. L., Conn, L. A., & Pinner, R. W. (1999). Trends in infectious disease mortality in the United States during the 20th century. JAMA, 281(1), 61-66. https://doi.org/10.1001/jama.281.1.61
213. Beck, M. A. (1996). The role of nutrition in viral disease. The Journal of Nutritional Biochemistry, 7(12), 683690. https://doi.org/10.1016/S0955-2863(96)00132-5
214. Hooker, B. S., & Miller, N. Z. (2020). Analysis of health outcomes in vaccinated and unvaccinated children: Developmental delays, asthma, ear infections and gastrointestinal disorders. SAGE Open Medicine, 8, 2050312120925344. https://doi.org/10.1177/0960327111407644
215. Miller, N. Z., & Goldman, G. S. (2023). Neonatal, infant, and under age five vaccine doses routinely given in developed nations and their association with mortality rates. Cureus, 15(7). http://dx.doi.org/10.7759/cureus.42194
216. Light, D. W., Lexchin, J., & Darrow, J. J. (2013). Institutional corruption of pharmaceuticals and the myth of safe and effective drugs. Journal of Law, Medicine & Ethics, 41(3), 590-600. http://dx.doi.org/10.1097/MLR.0b013e3180616c0a
217. Barosi, G., & Gale, R. P. (2018). Is there expert consensus on expert consensus? Bone Marrow Transplantation, 53(8), 1055-1060. https://doi.org/10.1038/s41409-018-0128-2
218. Djulbegovic, B., & Guyatt, G. (2019). Evidence vs consensus in clinical practice guidelines. JAMA, 322(8), 725-726. https://doi.org/10.1001/jama.2019.9751
219. Bragazzi, N. L., Watad, A., Amital, H., & Shoenfeld, Y. (2017). Debate on vaccines and autoimmunity: Do not attack the author, yet discuss it methodologically. Vaccine, 35(42), 5522-5526. https://doi.org/10.1016/j.vaccine.2017.08.018
220. Martin, B. (2015). On the suppression of vaccination dissent. Science & Engineering Ethics, 21, 143-157. https://doi.org/10.1007/s11948-014-9530-3
221. Elisha, E., Guetzkow, J., Shir-Raz, Y., & Ronel, N. (2024). Suppressing scientific discourse on vaccines? Selfperceptions of researchers and practitioners. In Hec Forum (Vol. 36, No. 1, pp. 71-89). Dordrecht: Springer Netherlands. https://doi.org/10.1007/s10730-022-09479-7
222. Kempner, J. (2008). The chilling effect: how do researchers react to controversy? PLoS Medicine, 5(11), e222. https://doi.org/10.1371/journal.pmed.0050222
223. Martin, B. (1981). The scientific straightjacket: The power structure of science and the suppression of environmental scholarship. Ecologist, 11(1), 33-43. https://documents.uow.edu.au/~bmartin/pubs/81ecol.html
224. Larsson, A., Oxman, A. D., Carling, C., & Herrin, J. (2003). Medical messages in the media–barriers and solutions to improving medical journalism. Health Expectations, 6(4), 323-331. https://doi.org/10.1046/j.1369-7625.2003.00228.x
225. Shuchman, M., & Wilkes, M. S. (1997). Medical scientists and health news reporting: A case of miscommunication. Annals of Internal Medicine, 126(12), 976-982. https://doi.org/10.7326/0003-4819-126-12-199706150-00008
226. Carroll, A. E. New York Times. (2018) [cited 2024 Aug 1]. Why it’s still worth getting a flu shot. Available from: https://www.nytimes.com/2018/01/11/upshot/flu-shot-risks-benefits-strain.html
227. Carroll, A. E. New York Times. (2017) [cited 2024 Aug 1]. A link between alcohol and cancer? It’s not nearly as scary as it seems. Available from: https://www.nytimes.com/2017/11/10/upshot/health-alcohol-cancer-research.html
228. Lipworth, W., Kerridge, I., Morrell, B., Bonfiglioli, C., & Forsyth, R. (2012). Medicine, the media and political interests. Journal of Medical Ethics, 38(12), 768-770. https://doi.org/10.1136/medethics-2012-100875
229. Wiley, K. E., Leask, J., Attwell, K., Helps, C., Barclay, L., Ward, P. R., & Carter, S. M. (2021). Stigmatized for standing up for my child: A qualitative study of non-vaccinating parents in Australia. SSM-population Health, 16, 100926. https://doi.org/10.1016/j.ssmph.2021.100926
230. Kennedy Jr, R. F. (2022). Profiles of the vaccine-injured: "A lifetime price to pay." Simon & Schuster.
Haftungsausschluss/Anmerkung des Herausgebers: Die in allen Veröffentlichungen enthaltenen Aussagen, Meinungen und Daten sind ausschließlich die der einzelnen Autoren und Mitwirkenden und nicht die von MDPI und/oder den Herausgebern. MDPI und/oder die Herausgeber lehnen jegliche Verantwortung für Personen- oder Sachschäden ab, die aus den im Inhalt erwähnten Ideen, Methoden, Anweisungen oder Produkten resultieren.
Preprints.org (www.preprints.org) | NICHT PEER-REVIEWED | Zugesendet: 10. Januar 2025 doi:10.20944/preprints202501.0796.v1